微波消融是一种微创、高效毁损肿瘤的治疗手段,其在微创外科中的应用至关重要。近日,解放军总医院第五医学中心朱震宇教授分享《微波消融在微创外科中的应用》专题报告,肝癌在线特将精彩内容整理成文,供临床医生参考。
一 腹腔镜下肝癌微波消融
微波消融的手术入路有开腹、经皮、腹腔镜三种。开腹消融创伤较大,经皮穿刺是常用的消融路径,在B超、CT、MRI等多种手段引导下进行,是简单且接近无创的治疗方法。危险部位的肝癌,如邻近膈肌、大血管、胆囊、胃肠道、突出于肝表面等,经皮消融治疗难以实现肝癌的安全消融边界,导致消融后肝癌复发率较高,容易出现出血、气胸、胃肠道穿孔等并发症。
腹腔镜微波消融技术融合了腹腔镜的可视性、术中超声的高分辨率及多种角度引导的精准性。腹腔镜超声探头为高频探头,能够获得分辨率较高的肝脏超声图像;直接在肝脏表面进行全面、无死角的扫查,避免胃肠道气体、肺部气体、肋骨等结构的干扰;术中可以通过游离牵拉肝脏、人工腹水等方法,降低并发症的发生;穿刺过程中便于改变穿刺位置及方向,以避开重要器官及胆管、血管等;可全程监测消融覆盖范围,对消融范围的判断更精准,对疗效的判断更直观。
01 病灶临近大血管、肝门
患者男性,71岁,因“乙肝病史15年余,肝癌综合治疗9年”于2022-07-09入院。既往2013年10月S4肝癌RFA,术后TACE辅助治疗。2016年7月在机器人辅助下肝S5肿瘤切除。术后病理示:(肝S5)肝细胞癌,中分化(GⅡ),大小:2×1.3×1.5cm,血管内癌栓形成,切缘未见肿物侵及。2020年10月因肿瘤复发,腹腔镜肝S6肿瘤射频消融术。2022-7-14复查MRI提示:肝占位综合治疗后改变,肝S5/6交界凝固坏死灶,与2021-12-14MR片相比,右尾叶及S5/6交界结节,考虑活性病变(图1)。
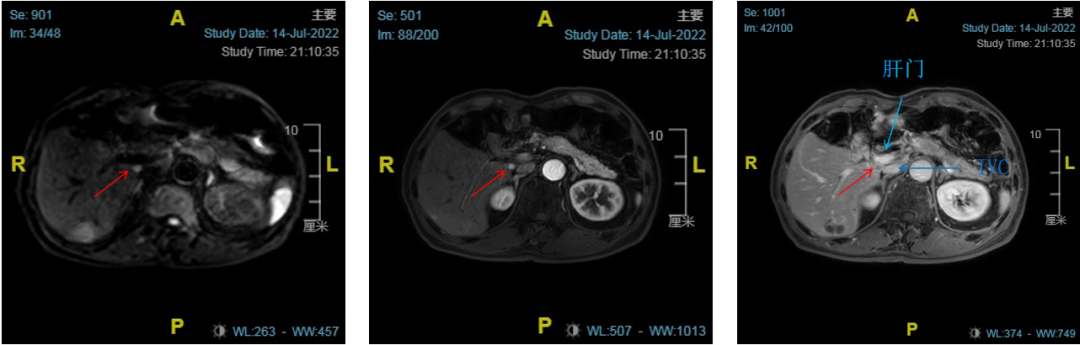
图1
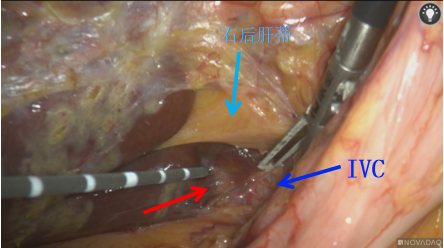
图2-S6/7切除,右尾叶病灶微波消融
02 病灶临近胃肠道
患者男性,44岁,诊断:1.原发性肝癌;2.乙型肝炎肝硬化;3.脾切断流术后。2016年12月行脾切除、贲门周围血管离断术,MRI提示肝左外叶病灶(图3)。
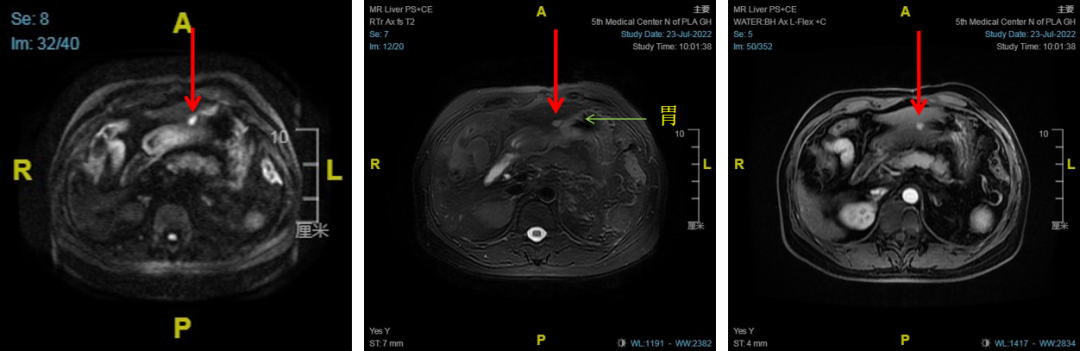
图3
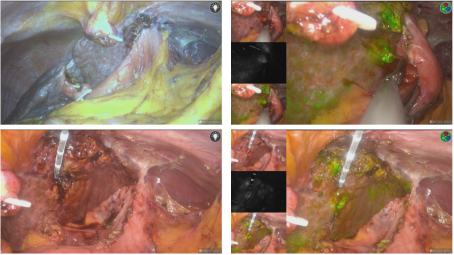
图4-荧光S3消融
03 外生性病灶
患者女性,55岁,诊断:1.原发性肝癌;2.PBC合并巨脾脾功能亢进。MRI提示肝硬化、巨脾,肝右叶占位性病变(图5)。
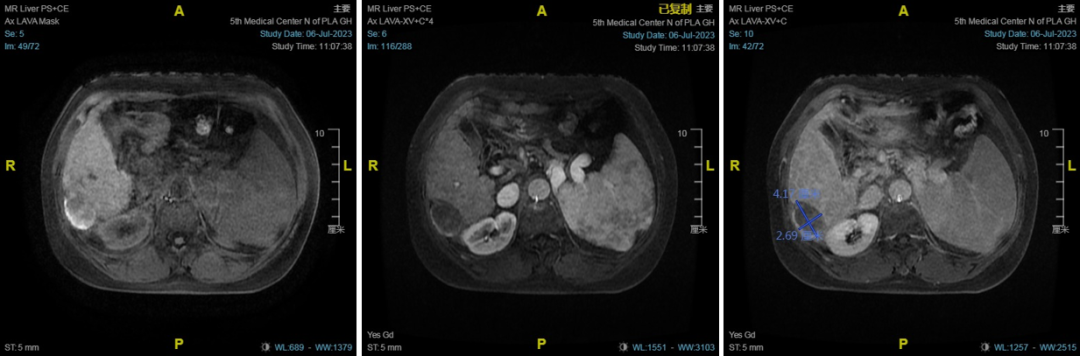
图5
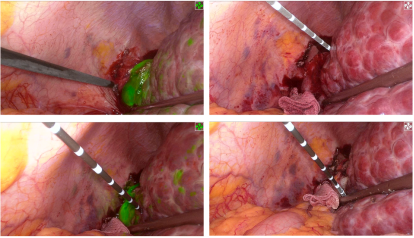
图6-肝癌微波消融,病灶长径4cm,由头侧向足侧依次消融
04 临近膈肌
患者女性,58岁,MRI提示肝S7异常信号结节,考虑小肝癌。脂肪肝,肝硬化,脾稍大,胃底静脉曲张,胃肾分流,动脉期肝内异常强化,考虑异常灌注(图7)。
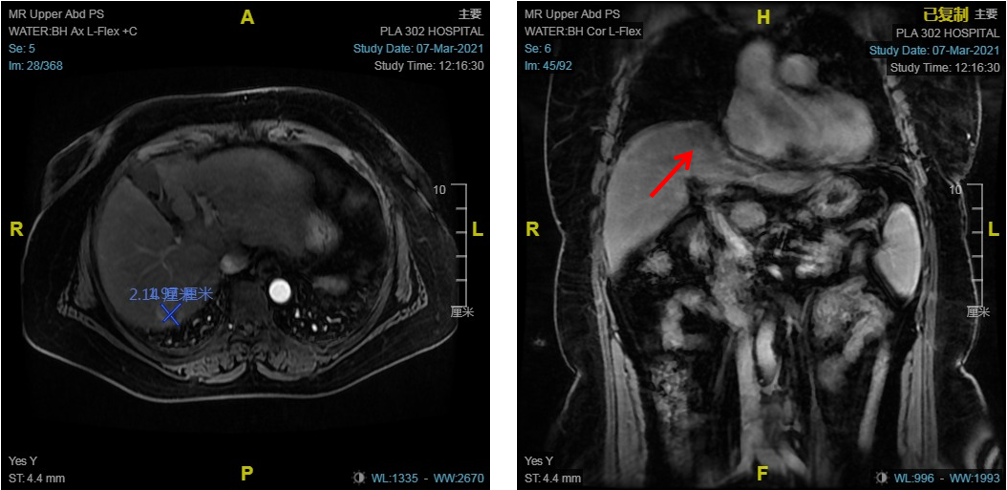
图7
图8-人工腹水
05 病灶紧邻肝门
患者男性,55岁,因“乙肝表面抗原阳性11月余,肝占位1月余入院。2023-04-08来院住院复查腹部MR:肝S5/8交界区,肝门区小结节,考虑肝癌(图9)。2023-04-12在CT引导下行肝癌氩氦刀靶向治疗。
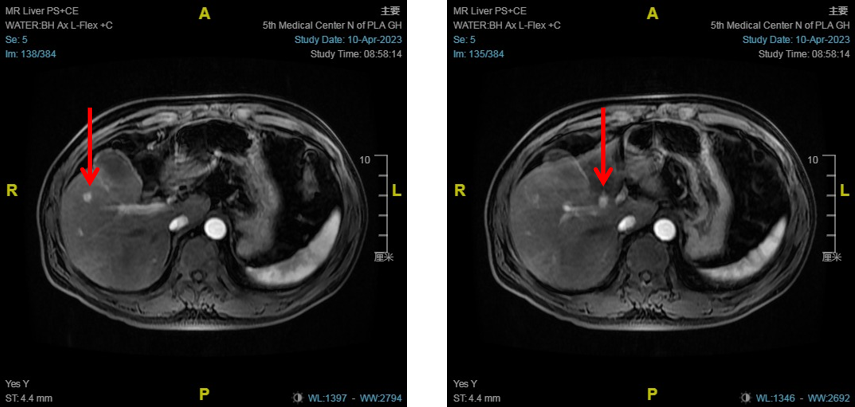
图9
术后1月复查MRI:与2023-04-10MR比较,肝S5/8交界区占位氩氦刀术后,原S5/8交界病变凝固坏死,肝门区强化结节,考虑残留活性(图10)。
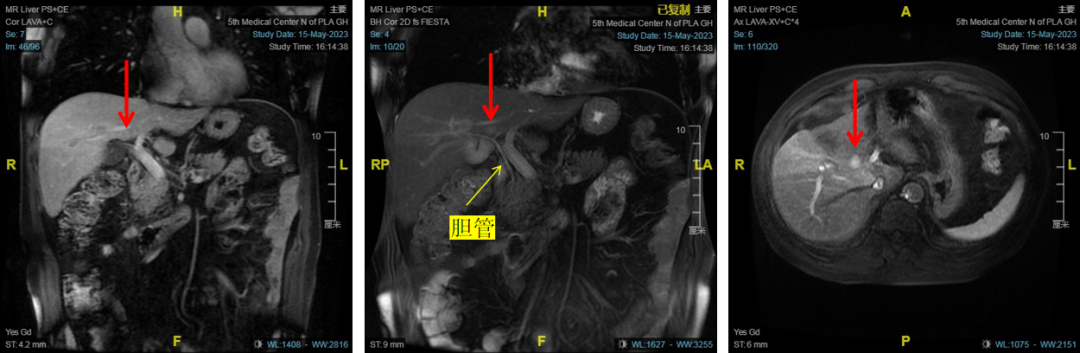
图10
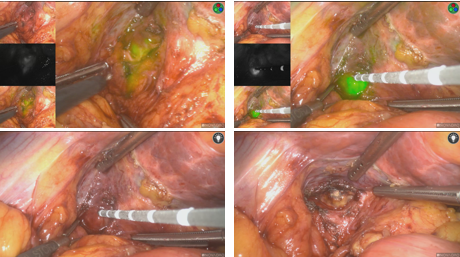
图11-病灶直视下不可见,下降肝门板后荧光引导精确定位
二 微波消融辅助治疗肝脏良性疾病
肝血管瘤是一种最常见的肝脏良性肿瘤,对于有症状的肝血管瘤,治疗手段主要为外科手术、介入栓塞和消融治疗等。相较于传统手术创伤大,术后恢复慢和并发症多等特点,患者更容易接受创伤小的微创介入治疗。但对于较大肝血管瘤,微波消融治疗在安全性和疗效方面需要进一步的研究。对于多发肝血管瘤,可采用外科微创切除联合微波消融治疗。
01 肝多发血管瘤
患者女性,49岁,因“体检发现肝占位9年余,右上腹不适1年”入院。患者于2015年6月26日常规查体发现肝占位,考虑肝血管瘤,大小为3×3㎝;后肝血管瘤逐渐增大,伴上腹部不适。MRI提示肝内见多发结节状及团块状长T1长T2信号影,较大者位于肝右叶,大小约5.3*5.6cm(图12)。
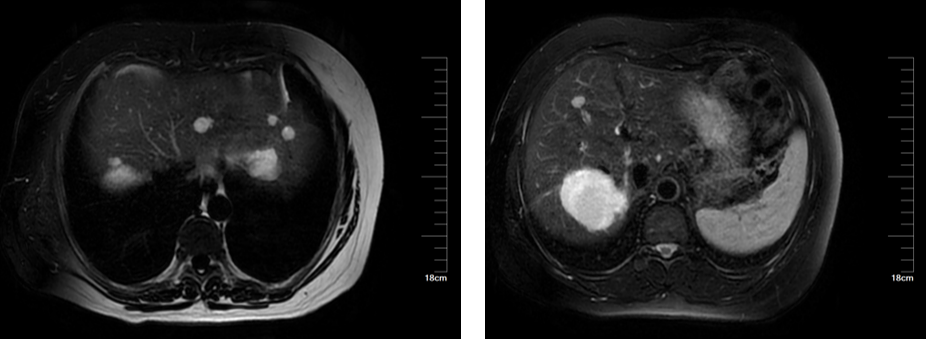
图12
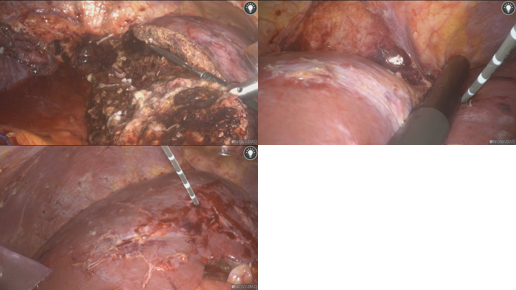
图13-S7病灶行手术切除,左外叶及肝右叶病灶行微波消融术
02 肝局灶性增生合并肝血管瘤
患者女性,33岁,因“体检发现肝占位1月余”于2023-12-11入院。腹部MRI提示:肝左叶、肝尾状叶异常信号影,考虑肝局灶性结节性增生可能性大。肝右叶血管瘤。左外叶及尾叶病灶行手术切除,S6病灶行微波消融术(图14)。
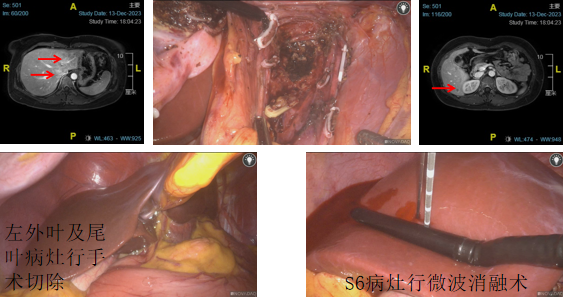
图14
三 微波消融辅助的ALPPS
1、背景
联合肝脏分隔和门静脉结扎的二步肝切除术(ALPPS)是Schlit于2007年肝门胆管癌根治行右三肝切除术时发现残余肝体积不足,遂采取离断肝脏,结扎门静脉右支,二期切除患侧肝脏,偶然创立的一种手术方式。2012年,Schnitzbauer等汇总报道25例该手术,正式命名为ALPPS。ALPPS扩大了肝癌根治性切除术的适应症,给原本失去手术机会的病人带来了新的治疗机会。但其往往伴有较高的并发症发生率和死亡率,因此需严格把控手术的适应症和禁忌症。
2、ALPPS肝脏再生机制
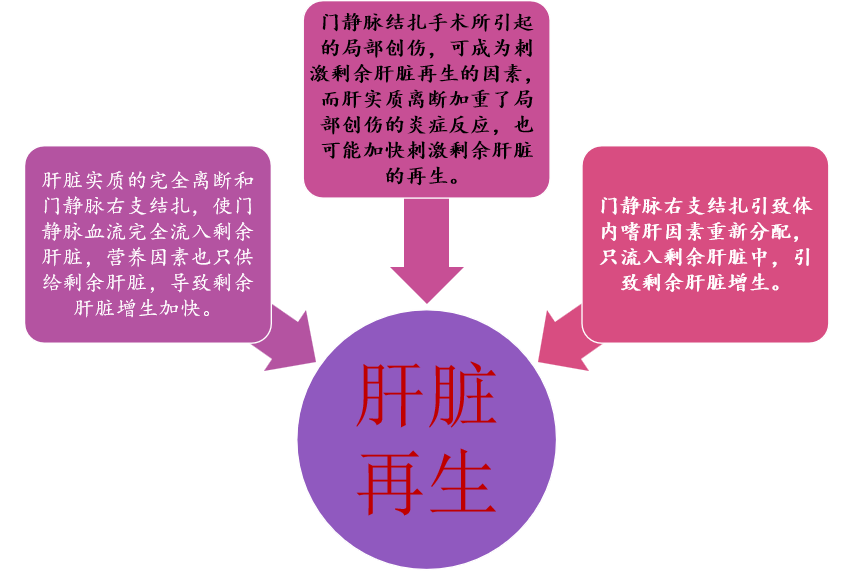
图15-ALPPS肝脏再生机制
3、ALPPS手术适应症及禁忌症
(1)适应症

图16-适应症
(2)禁忌症

图17-禁忌症
4、ALPPS手术方法
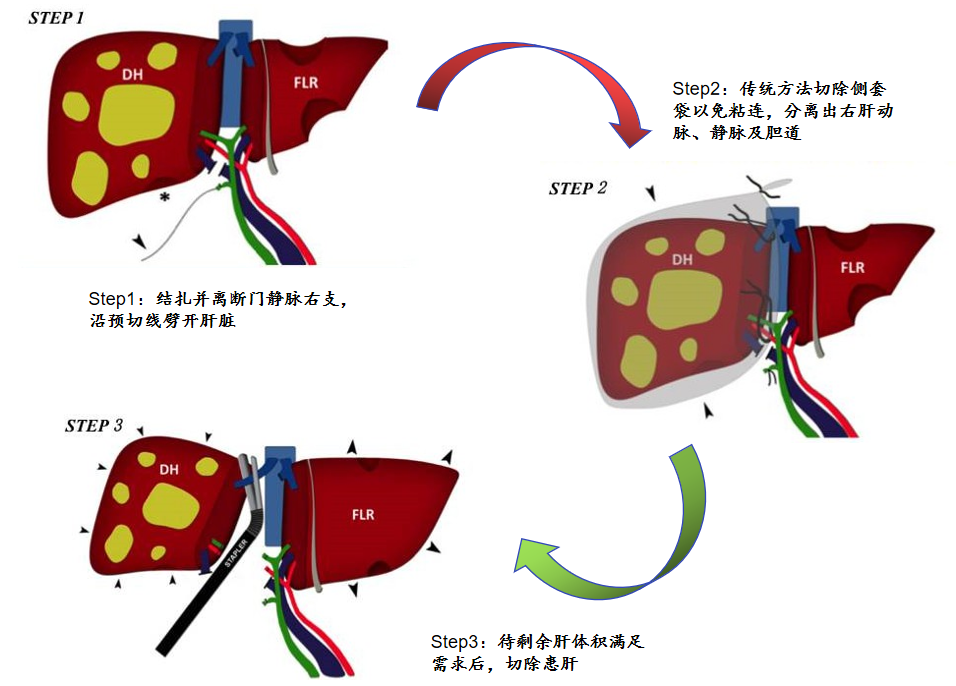
图18-ALPPS手术方法
5、病例详情
张xx,男,46岁,身高170cm,体重58kg;既往乙肝病史10年,未治疗。2018年11月10日因“乙肝表面抗原阳性10余年,发现肝占位2年余”首次入住我科;患者缘于10余年前查体发现乙肝表面抗原阳性,未行抗病毒治疗。2年前因右上腹隐痛不适于当地医院检查,发现肝占位(大小、位置具体不详),未行进一步诊治。于2018年11月6日在当地医院行腹部MRI提示:肝硬化;肝右叶占位性病变,考虑原发性肝癌。
【临床资料】
实验室检查:血常规:RBC:5.14×1012/L、WBC:5.76×109/L、HGB:149.00g/L、PLT:356.00×109/L;肝功能:AST:53U/L、r-GT:89U/L、ALB:39g/L、CHE:8394U/L、LDH:266U/L、DBIL:2.8μmol/L、ALT:34U/L、TBIL:7.6μmol/L;凝血功能:FIB:2.39g/L、PT:11.4s、PTA:92.8%、INR:0.99;AFP>1210.00ng/ml,HBV DNA:5.67X104IU/ml。CT示肝右叶可见团块状低密度影,范围约10.4x16.0cm,相邻肝缘凹陷,增强扫描:动脉期病变呈轻度强化影,门脉期及延迟扫描病变造影剂消退,延迟扫描病变呈低密度影。肺部影像学未见转移。诊断:1、原发性肝癌;2、乙型肝炎肝硬化代偿期。
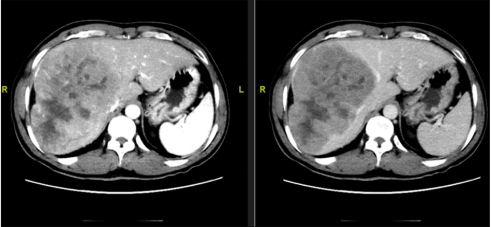
图19-影像学
第一种方案:右半肝切除-FLR/SLV 35%
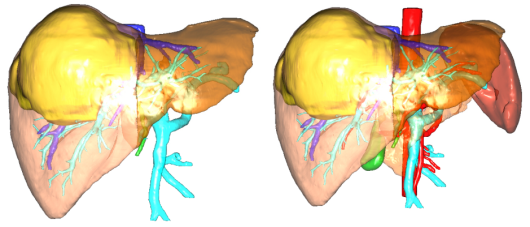
图20-右半肝切除-FLR/SLV 35%
第二种方案:右三肝切除
肝功能分级:Child分级A级;评估ICG 15分钟滞留率:1.9%;标准肝脏体积(SLV)=1153.7ml,剩余肝左外叶体积(FLR/SLV)24%;影像学肿瘤位于肝右叶,无肝外转移。
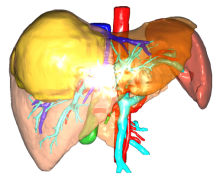
图21-右三肝切除
第一阶段手术:2018年11月19日腹腔镜下胆囊切除术+门脉右支结扎术+微波消融术。
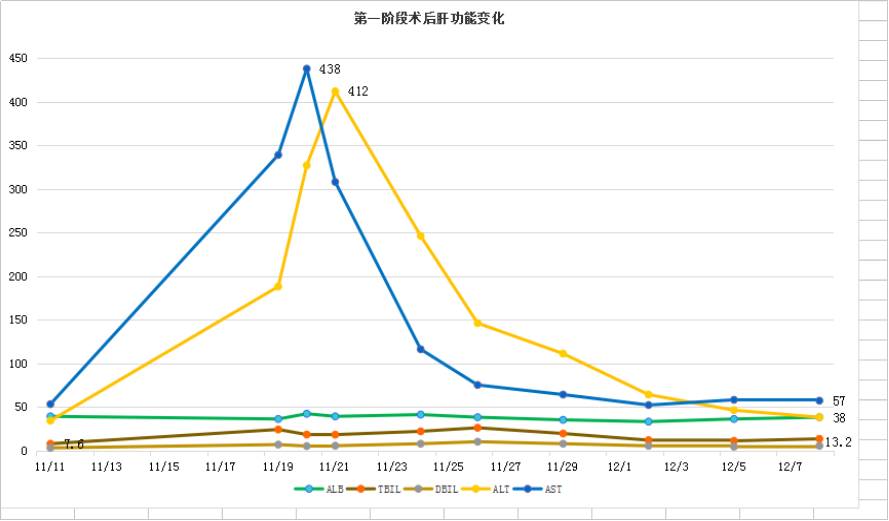
图22-第一阶段术后肝功能变化
11月26日(术后7天)FLR/SLV 35%(如图23)。
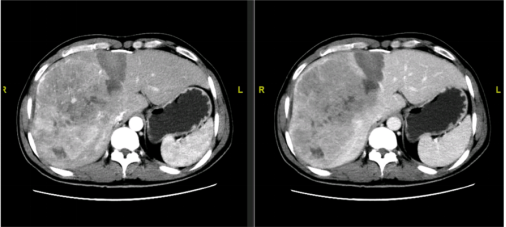
图23-FLR/SLV 35%
12月3日(术后14天)FLR/SLV 40.1%,ICG-R15:7.2%(如图24)。
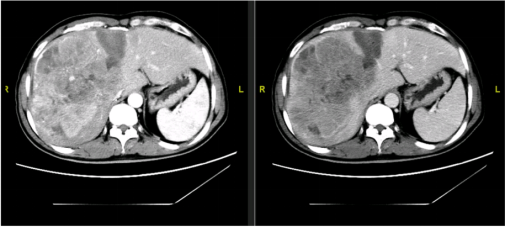
图24-FLR/SLV 40.1%,ICG-R15:7.2%
12月10日(一期术后21天)第二阶段手术。分离右肝动脉及右肝管,离断右肝动脉,离断并缝扎右肝管。采取前入路右三肝切除术,超声刀切肝,离断左肝静脉属支,分离肝实质,离断肝短静脉,离断右肾上腺静脉,Endo-GIA离断右肝静脉及中肝静脉,游离右侧肝周韧带,缝扎右肾上腺组织,胆道修补并放置T管。标本(图25)
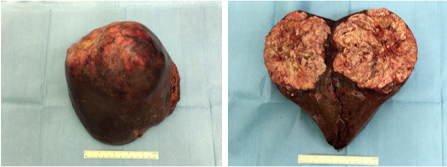
图25
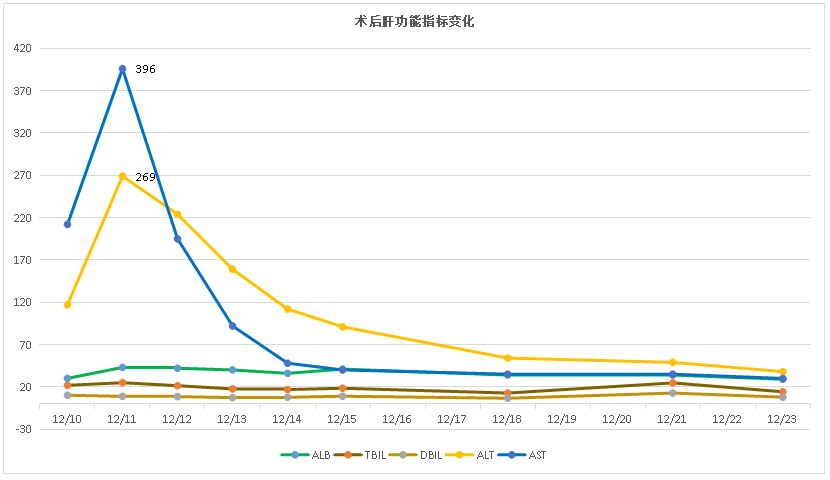
图26-术后肝功能指标变化
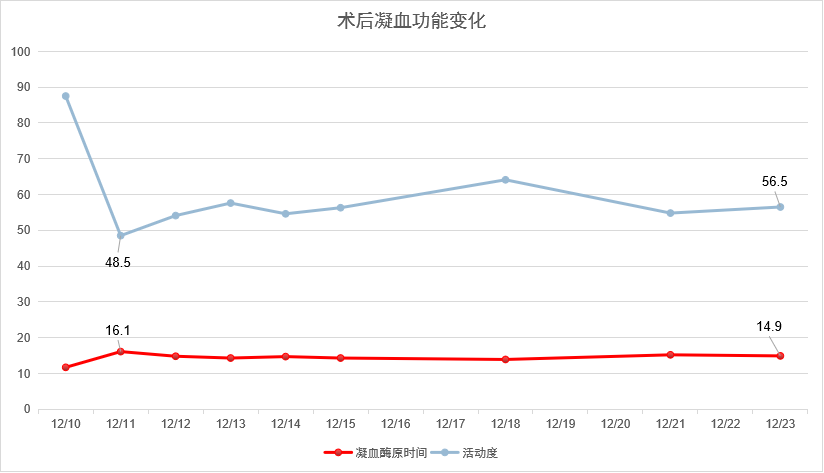
图27-术后凝血功能变化
Clavien-Dindo手术并发症Ⅰ-Ⅱ级;患者恢复良好,术后13天顺利出院。术后病理:(右三肝)肝细胞癌,中分化(GⅡ-Ⅲ),大小:15×11×10cm,脉管内见癌栓,肿瘤距切缘最近处1.5cm,未见肿瘤组织。T2NXMX。背景肝组织病毒性肝炎肝硬化,乙型,活动期;Leannec分期F4B。免疫组化:肝细胞:HBsAg(+++),HBcAg(-)。术后6个月(图28)。
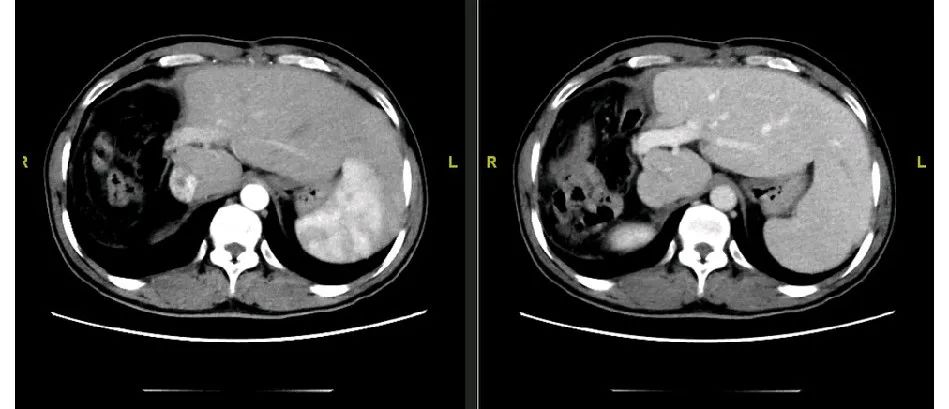
图28-术后6个月
小结
1 经腹腔镜微波消融术(LMWA)对于肝表面(如膈顶、左外叶等)和外生型肿瘤有着极大的优势,肿瘤靠近周围空腔脏器(如胃、肠道等)、膈肌、心脏等位置时也对周围组织和器官有较好的保护作用。
2 LMWA与切除的结合治疗肝脏良性肿瘤。
3 和传统ALPPS术式相比,以热消融代替一期肝脏离断是一种相对安全、简化的手术方式;经过严格把控手术适应症和禁忌症,对于肝功能良好的进展期肝硬化肝癌患者,其剩余肝脏体积(FLR)可以较好的增长。