研究背景
胃穿孔是胃的全层损伤,主要原因是严重的胃溃疡,少量来自胃癌,偶尔在内窥镜检查、创伤等中出现。胃穿孔可引起胃内化学刺激性内容物流入腹腔,导致严重腹痛和急性弥漫性腹膜炎,甚至危及生命,需要紧急治疗。长期以来,手术修复是急性胃穿孔的常规治疗手段,然而,外科治疗具有较大的侵入性,且手术时间长,容易导致病程延长。内镜下钛夹密封穿孔是另一种常见的治疗方法,但对于周围组织坚硬的溃疡性穿孔,钛夹的治疗效果并不理想。近年来,内窥镜植入物封堵为胃穿孔治疗提供了一种新的策略。然而,目前使用的封堵材料主要是不可降解的金属或塑料,需要通过二次手术移除。因此,研发一种内镜下可递送、有效封堵胃穿孔的可降解封堵器具有重要的临床意义。

近日,陆军军医大学新桥医院消化内科樊超强教授、杨仕明教授团队联合加拿大工程院院士、曼尼托巴大学邢孟秋教授团队在《Advanced Science》作为封面文章报道了一种来源于竹荪的天然可降解胃穿孔封堵器。该封堵器由天然多级多孔结构的可降解生物材料制备而成,该材料具有超弹性、亲水性、形状记忆性、良好生物相容性、可降解性及止血性能。特别适合修复伴有反复机械运动的胃穿孔。在小型猪急性胃穿孔模型中,该封堵器可以通过内窥镜快速递送、并有效封堵穿孔部位。在为期2个月的随访中,通过内镜观察和组织学评估,证实了其具有封堵胃穿孔、促进伤口愈合的疗效。相关研究结果以“Analyzing Mushroom Structural Patterns of a Highly Compressible and Expandable Hemostatic Foam for Gastric Perforation Repair”为题,发表于Advanced Science。文章被Wiley 选中,并作为Hot Topic推荐 。
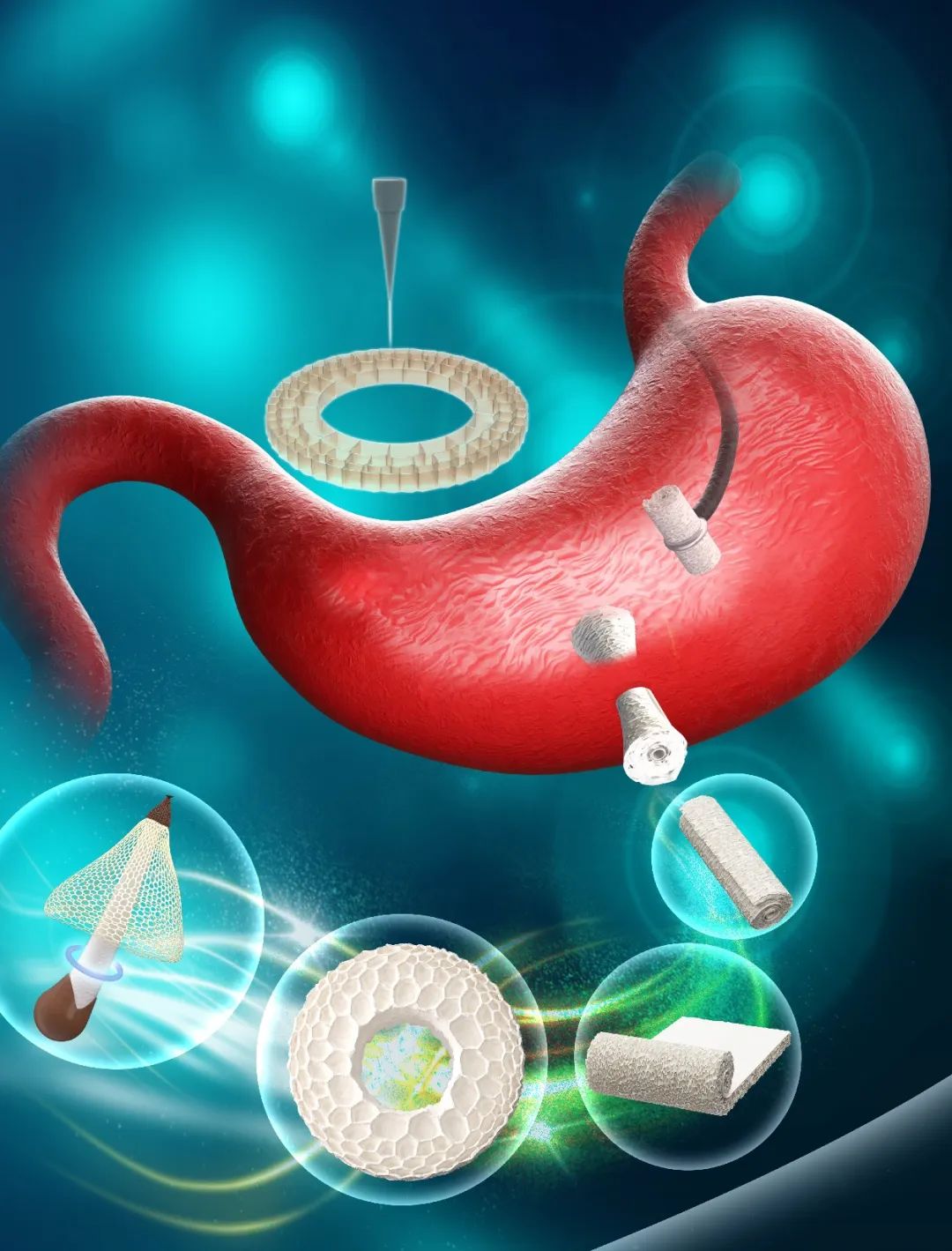
杂志封面图
Hot Topic推荐
研究内容
竹荪菌柄的形态表征及数学公式表达
竹荪(DR)是一种可食用真菌,发育成熟过程只有几个小时(图1A)。由于这种特殊的生长方式,竹荪两侧结构具有不对称性(图1B)。竹荪外侧面具有半开放的多孔结构,直接暴露于生长环境中(图1C c1-c2);内侧面是一层光滑的膜 (图1C c3-c4)。在横截面上观察到分层多孔结构(图1C c5-c6)。Micro-CT图像显示孔隙直径由内到外逐渐减小。具有特殊内部排列的结构是竹荪独特而迷人的特征。
我们定义空心截面的半径为R,每层从内到外的平均直径为D1, D2, D3(图1E)。R和D之间的关系模型表现为显著的复合四次线性模型(图1F)。通过回归分析,我们得到如下方程:
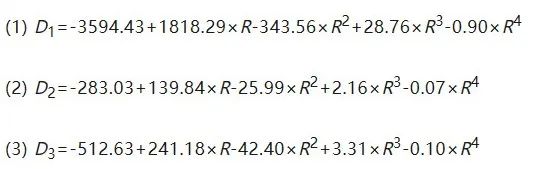
该公式可以预测三个内径(D1、D2、D3)的大小,作为空心半径R大小的函数(模型拟合的可决系数达到0.95以上,预测能力较好)。我们认为,每个层圆的两个半径决定了内部多边形的数量,并固定了三层(N1、N2、N3)中的多边形数量。因此,我们构建了三个二元完全多项式回归模型来准确预测每一层的数量:
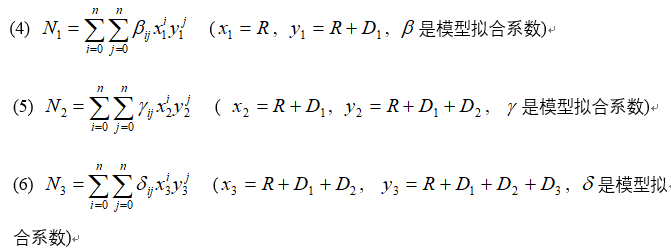
通过软件分析,我们发现当n的度数为3时,可以达到更好的预测效果。从表示D、R和N之间关系的二维模型图中可以看出,它们之间存在极好的曲线关系。预测校准图显示,预测值与实际值非常接近(图1G,模型拟合的可决系数达到0.95以上)。
通过设定竹荪的中空半径R,使用先前的模型预测D1、D2、D3、N1、N2、N3,并通过计算机模拟模拟DR的截面模式图。例如,当我们取空心半径R=8.6时,我们可以通过前面的模型随机设置:
D1=2.85, D2=1.92, D3=1.22, N1=17, N2=33, N3=45.
使用上述七个参数和MATLAB软件,可以获得DR横截面的计算机模拟图像和注释图(图1H、 I)。
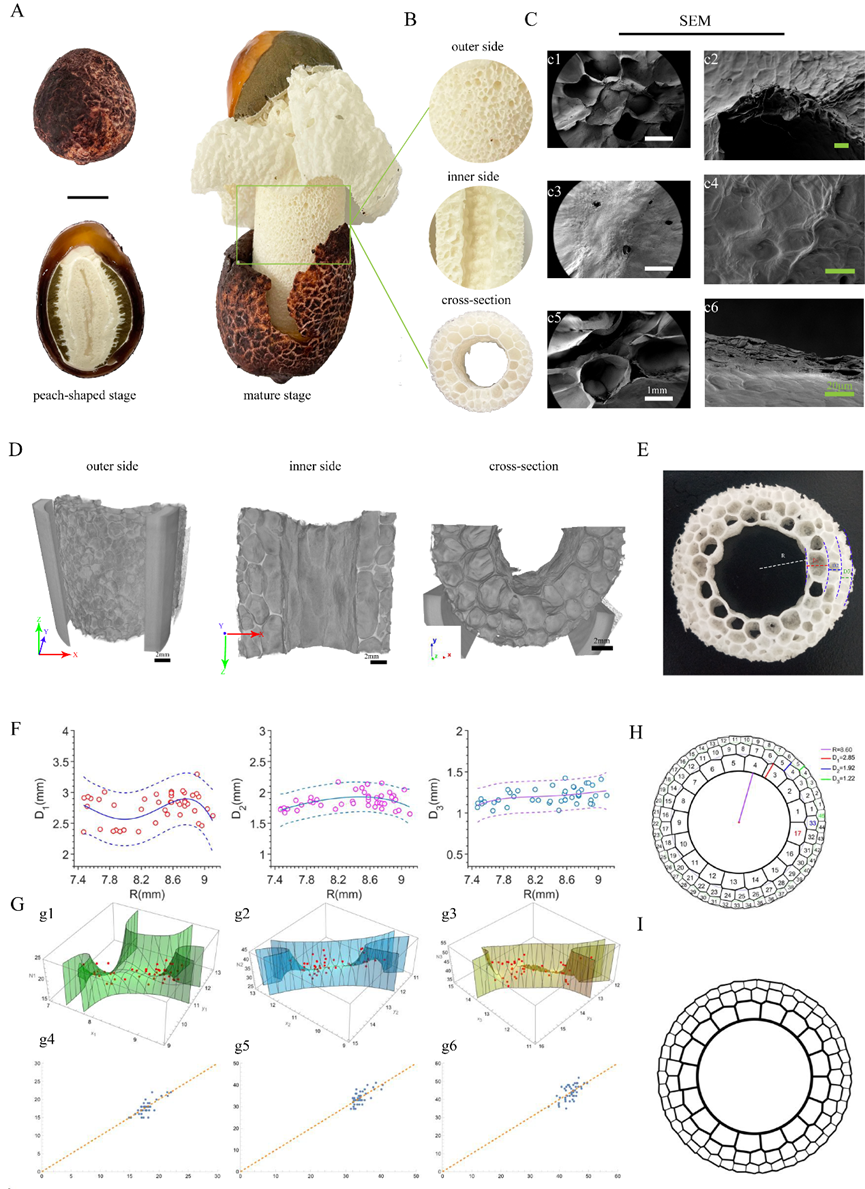
图1 竹荪的形态和结构
三维(3D)打印硅胶模型及其压缩弹性
通过计算机建模,成功获得了竹荪模型3D打印模型(图2 a1),利用生物硅胶成功打印出了仿生竹荪材料(图2 a2),得到的仿竹荪材料具备弹性,能进行折叠及压缩(图2 a3-4)。用生物硅胶打印的直径2.5cm,厚8mm的仿竹荪模型(图2 b1)和大小相同的同心圆模型(图2 b4),分别在平行或垂直于横切面的方向对模型进行循环压缩实验。在相同的应变与速度下,不论在平行或垂直方向,竹荪模型的最大压缩强度(图2 b2,b3)都明显大于同心圆模型(图2 b5,b6)。结果说明竹荪内部具备数学规律的孔隙结构可能使其具备天然的良好压缩弹性和强度。
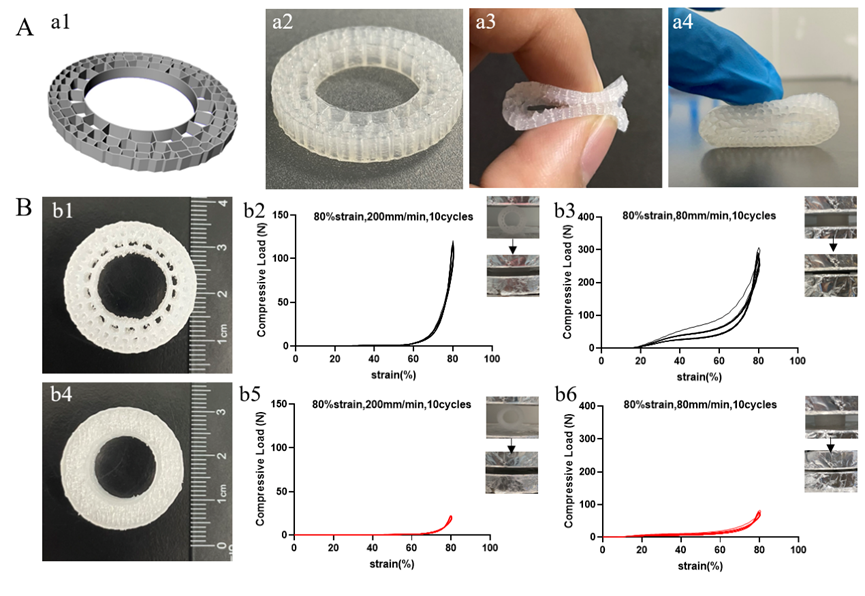
图2三维仿生模型及其压缩弹性。
脱细胞冻干竹荪形态学观察
我们通过SEM观察新鲜竹荪菌柄和脱细胞冻干竹荪菌柄(DDRS)的形态(图3A)。可以看出,在脱细胞冷冻干燥处理后,竹荪在宏观和显微结构上与新鲜竹荪相比没有明显变化,说明脱细胞未对形态结构造成破坏。为了评估脱细胞效果,使用不同的染色方法观察脱细胞前后的竹荪菌柄用石蜡切片(PAS、Gimesa、CWS)(图3B)。可以看出,在不同的染色方法下,脱细胞前后竹荪菌柄的细胞形态没有显著变化,并且没有明显的细胞核或细胞质被着色。为了显示DDRS更细微的结构,我们补充了TEM检测(图3C)。结果显示,细胞壁之间的明显边界形成了一个暗-亮-暗系统,这可能有助于水分子或其他物质在细胞之间的进出。
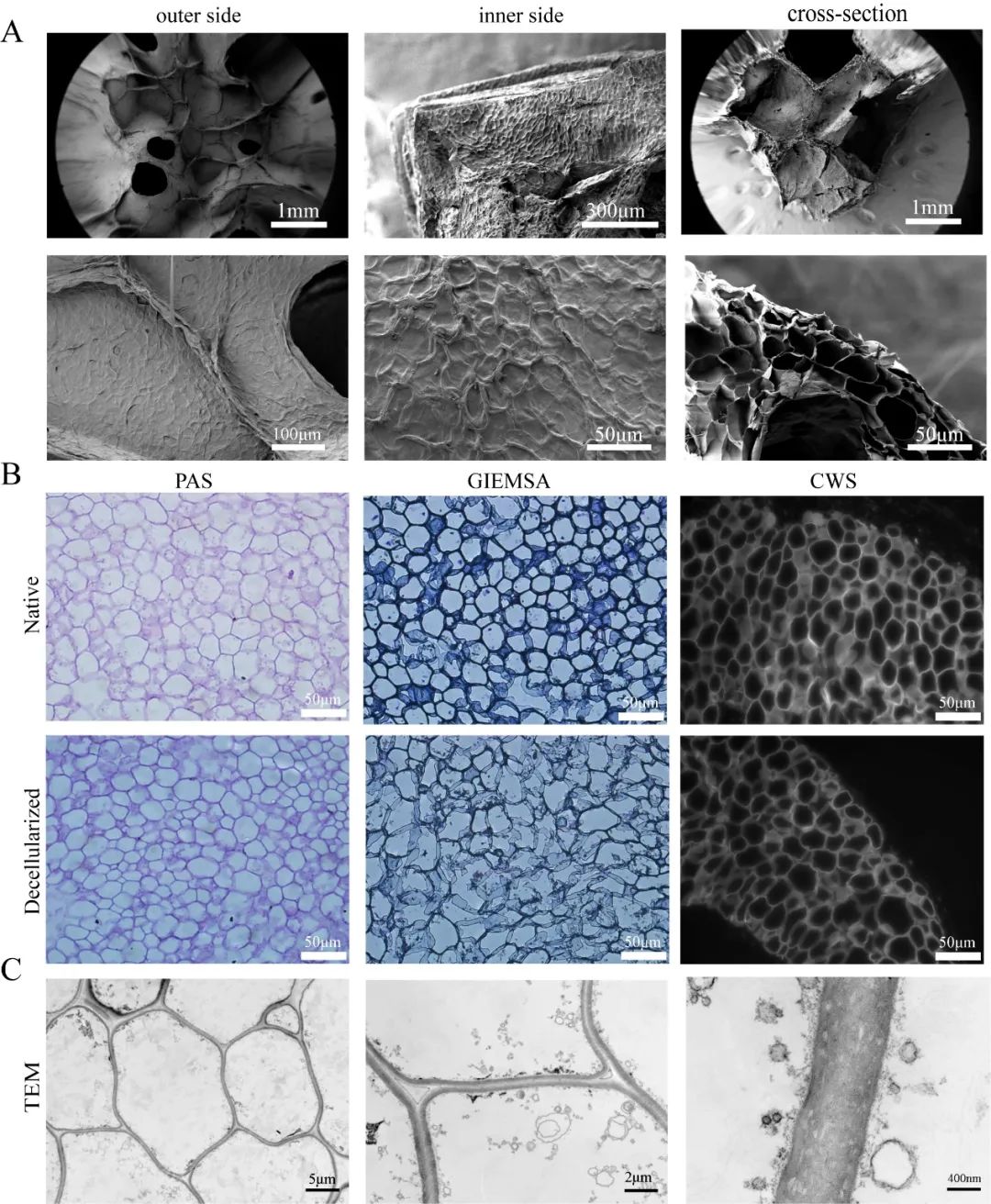
图3 DDRS的形态及脱细胞效果
吸水性和渗透特性测试
DDRS可以吸收超过其重量25倍的水分(图4 A、B),同时,由于材料多级孔隙的存在,吸水后膨胀率并不高。当DDRS材料以不同的面朝下放置在稀释的品红色试剂中时。我们发现,外表面朝下渗透速率越快(图4 C)。当10μl稀释的Gimesa溶液和荧光素钠溶液分别滴在DDRS材料的两侧时,也可以看出,从外侧的渗透速度比内侧的快(图4 D)。同时,当还在材料表面添加5μl抗凝血时,结果与以前的结果相似,并且都比明胶海绵(GS®)快。可能是由于DDRS的多层和分级孔结构,其中分布在竹荪外侧的网状开孔使液体在进入大孔后能够快速扩散,在内侧面缺乏这种结构。总之,DDRS表现出明显的亲水性,内外两侧不对称的结构的孔隙分布使其与液体反应时表现出不同的渗透效果。
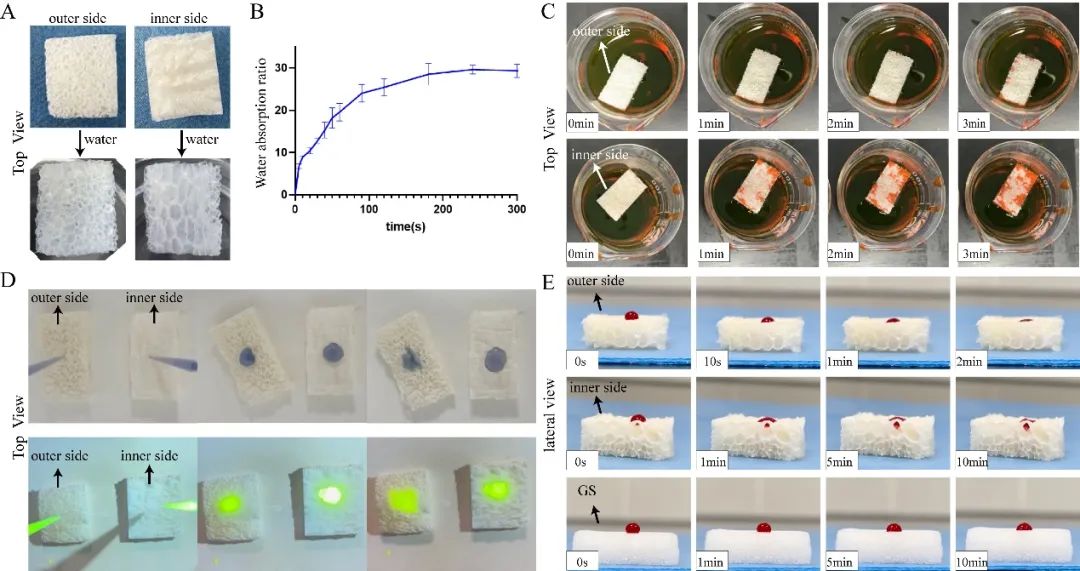
图4 DDRS的吸水性以及渗透性能
循环压缩实验
除了吸水性外,DDRS还具有优异的压缩弹性。在完全吸收水之后,材料DDRS在90%的最大应变下完成10个循环压缩并回复圆状(图5A)。在挤出水并折叠几次后,DDRS也可以在水中恢复其原始形状(图5B)。此外,与明胶海绵相比,DDRS在循环压缩下也表现出更大机械强度(图5C–H),在相同的压缩速率和应变(40mm/min和10个循环)下,DDRS的最大抗压强度可以是明胶海绵的10倍,特别是在90%应变下,DDRS的最大抗压强度可达200 kPa。
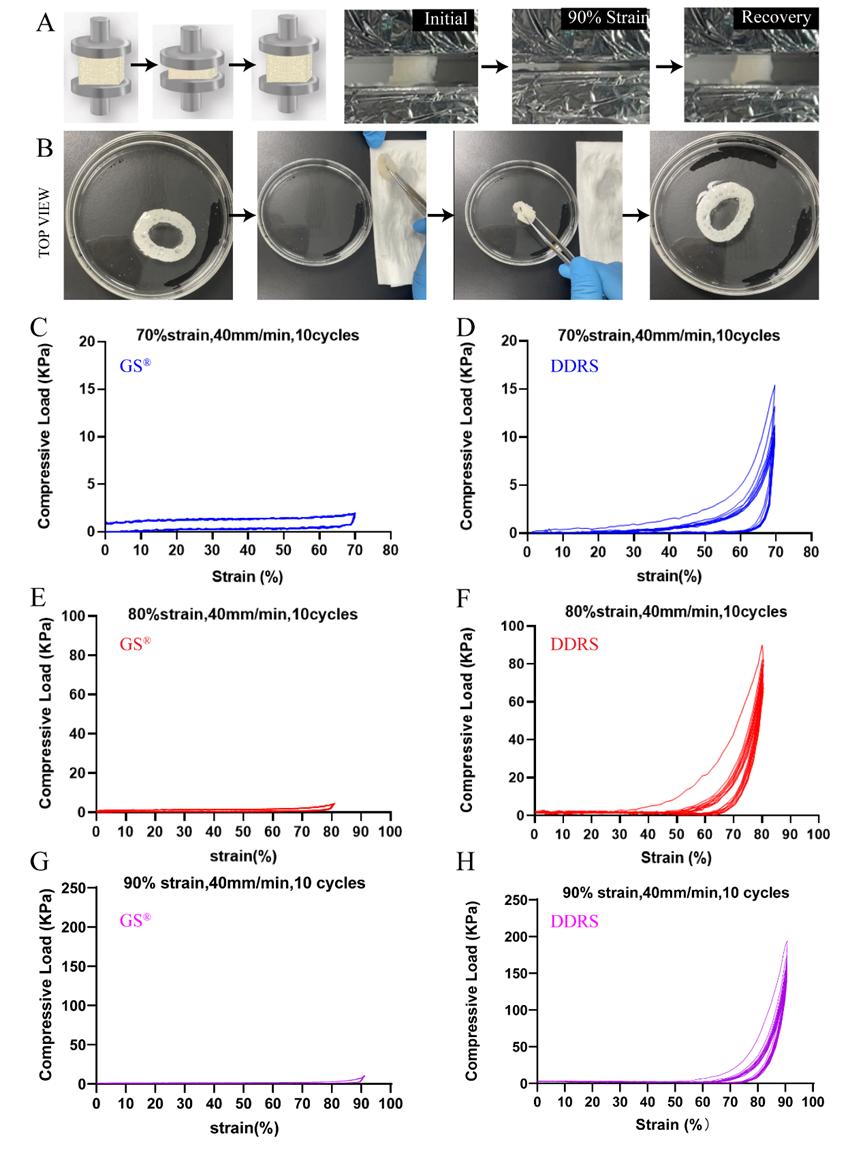
图5循环压缩实验和形状记忆性
DDRS的组织相容性和可降解性
我们通过大鼠皮下包埋试验评估了材料的降解性(图6 a1)。将厚度为0.5cm的DDRS切割成直径为1cm的正方形材料,然后在灭菌后植入大鼠背部(图6 a2,a3)。在不同的时间点观察到材料的降解。在第2周、第4周和第6周,去除剩余材料,测量重量,绘制重量-时间降解曲线。与第2周相比,质量尺寸在第4周显著减小,6周后,材料完全降解(图6 E)。H&E结果显示,异物反应的严重程度随着时间的推移而降低(图6 C)。除了生物降解性外,DDRS还表现出优异的生物相容性。将DDRS在完全培养基中浸泡24小时,并稀释获得不同浓度(1mg/ml、0.75mg/ml、0.5mg/ml、0.25mg/ml)的提取物。使用完全培养基作为空白对照组。在样品浸泡溶液和普通培养基中连续培养3天3T3细胞的数量,CCK8观察活细胞的数量。可以看出,每个浓度样品的饱和溶液与对照组之间没有显著差异,表明DDRS没有明显的细胞毒性(图6 D)。
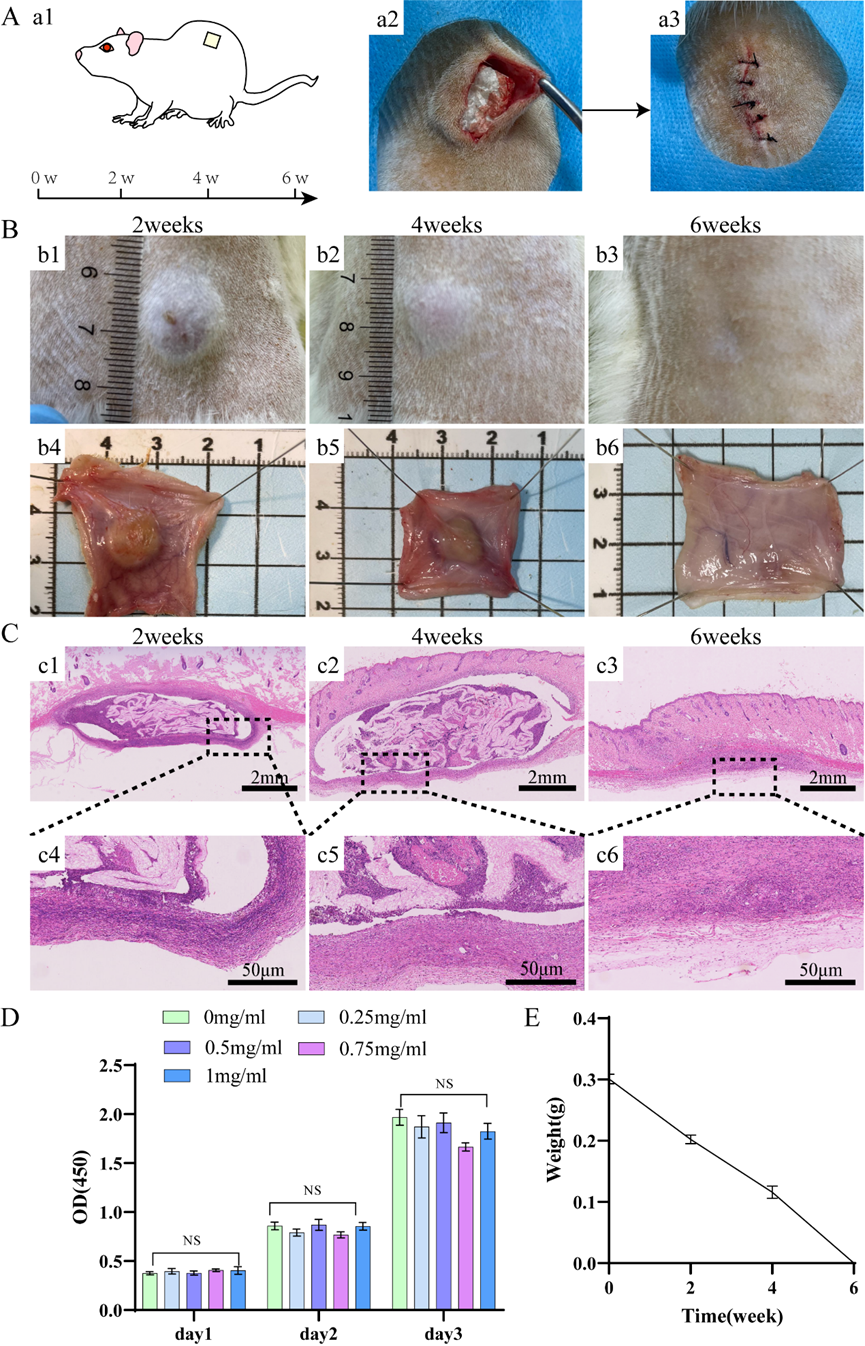
图6 DDRS的组织相容性、细胞相容性和降解性
DDRS体外止血实验
我们探讨了DDRS的止血能力。与传统的止血明胶海绵相比,DDRS和GS®与抗凝剂反应一段时间,然后在SEM下观察。DDRS和抗凝剂接触40秒后发生血小板聚集和纤维蛋白网络形成;然而,在作为对照组的明胶海绵组中没有发现这种现象(图7A)。为了更直观地显示,我们放大SEM图像并对其着色(图7B),蓝色表示活化的血小板,红色表示红细胞,白色表示纤维蛋白网络。同时,在止血材料与血小板反应的条件下,DDRS表面的血小板在反应1分钟后显著聚集并形成纤维蛋白网,而明胶海绵组在SEM下发现分散的未活化血小板和少量聚集的血小板(图7C)。我们将DDRS制作为洋葱卷状封堵器(图7 D)。在离体猪胃上剪一个直径5mm左右的缺口(图7 e1),装水后可见到水从穿孔部位泄漏(图7 e2);并使用DDRS对穿孔部位进行封堵后(图7 e3),缺口处不再漏水(图7 e4)。将刚才填充有竹荪封堵器的猪胃放置在烧杯上,并在表面倒入模拟胃液。24小时后未发现液体泄漏(图7 e6)。为了研究DDRS与凝血系统之间的相互作用,使用自动凝血仪来评估DDRS对凝血因子的影响。如图7 F所示,DDRS显示凝血因子活性升高,因子VII活性显著增加。

图7 体外止血及体外胃穿孔修复
内窥镜下活体猪胃穿孔封堵实验
为了进一步证明DRRS封堵器可以通过内窥镜递送来治疗胃肠道穿孔,我们使用了体内小型猪胃穿孔模型(图8A)。在内窥镜下用电刀在胃大弯侧制作直径约5 mm的穿孔模型(图8B)。将该装置夹在内窥镜下进行密封(图8C)。观察3分钟后,发现DDRS封堵器逐渐膨胀并固定在穿孔位置(图8D)。第7天,装置被胃黏膜包裹,伤口逐渐闭合,伤口周围无液体渗漏。第14天,手术部位的胃黏膜完全修复(图8F)。治疗两个月后,在内镜下观察胃组织(图8H),手术部位的胃黏膜完全修复。采集的胃组织HE染色显示,闭合的胃穿孔与再生的黏膜完全桥接,胃黏膜实现了全层修复。修复部位的胃黏膜比伤口周围的黏膜稍厚,这是胃黏膜愈合过程中的组织增生修复表现。上述结果表明,DDRS封堵器可以通过内窥镜输送到穿孔部位,在体内释放并促进伤口闭合和愈合。
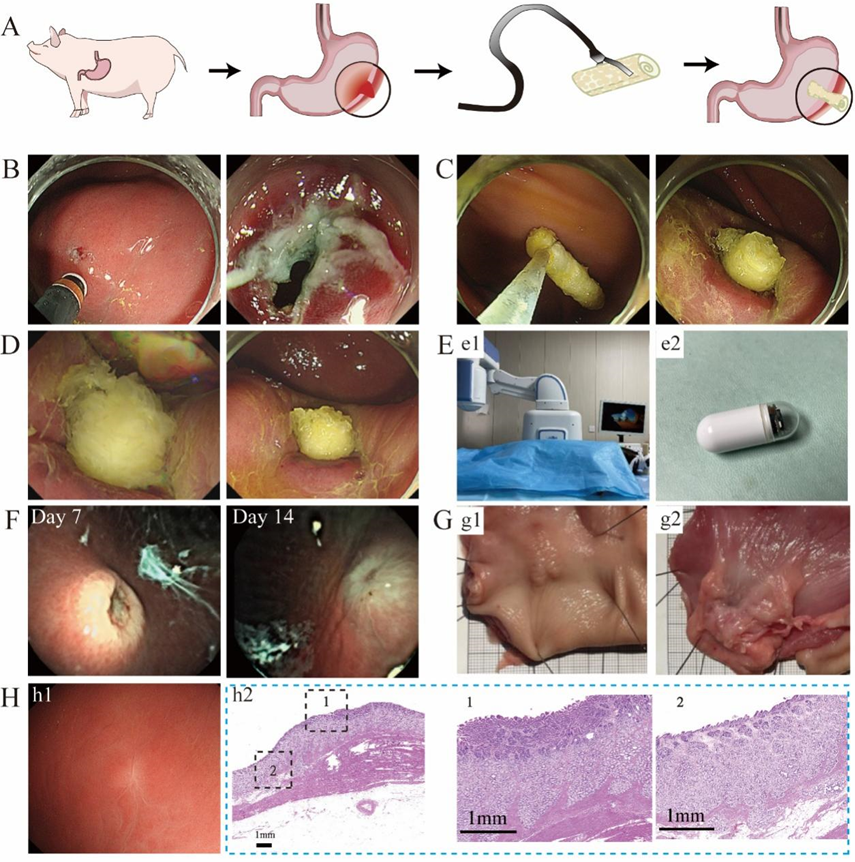
图8 通过内镜对猪胃穿孔的封堵和愈合进行评估
总结与展望
一种来源于竹荪的具有超弹性的多级多孔天然生物材料可用于制备胃穿孔封堵器。在小型猪急性胃穿孔模型中,该封堵器可以通过内窥镜快速递送,并能够有效封堵穿孔部位,促进伤口愈合。与传统的胃穿孔治疗方法相比,该新型封堵器具有可降解性、良好的生物相容性、潜在的止血能力和手术操作简便等优点,为胃穿孔的治疗提供了新思路。
陆军军医大学新桥医院消化内科樊超强教授、杨仕明教授和加拿大工程院院士、曼尼托巴大学邢孟秋教授为该文章的通讯作者,舒贞贞硕士、刘恩助理研究员和黄瑜副研究员为该文章的共同第一作者。该研究得到重庆市医学科研项目(重庆市卫生健康委与科技局联合项目)和国家自然科学基金等多个项目的支持。
原文链接:
https://onlinelibrary.wiley.com/doi/10.1002/advs.20230691