病例回顾
患者男,59岁,右肺腺癌术后接受紫杉醇+顺铂化疗(TP方案)。化疗前12、6h分别肌内注射地塞米松10mg,化疗前30min肌内注射异丙嗪30mg。
静脉滴注紫杉醇约90min时突发呼吸困难、心慌、皮肤潮红,血压降至70/40mmHg(1mmHg=0.133KPa)。
处理过程
地塞米松10mg
立即给予患者地塞米松10mg静脉注射,20min后未缓解。
甲泼尼龙40mg
给予患者甲泼尼龙40mg 静脉注射,同时予多巴胺升压,10min后患者症状稍缓解,但诉持续心慌。
利多卡因50mg
床旁心电图示室性心动过速,心室率144次/min,予利多卡因50mg静脉注射。10min后患者心慌、呼吸困难缓解,心电图示心律转为窦性心动过速。继续给予吸氧、脱敏等对症治疗。共住院11d,患者未再发生心律失常,病情平稳出院。
已行预处理为何仍然发生过敏反应?
紫杉醇注射液的说明书中提到“为预防严重的过敏反应,可于本药治疗前给予预防用药:治疗前12h和治疗前6h口服地塞米松20mg,或治疗前30-60min静脉滴注地塞米松20mg;治疗前30-60min静脉给予或深部肌内注射苯海拉明(或其同类药)50mg;治疗前30-60min静脉滴注西咪替丁300mg或雷尼替丁50mg”。
病例中,患者化疗前给予10mg地塞米松,药师认为没有达到有效的预防剂量,故导致紫杉醇过敏事件的发生。医生给患者用药时要严格遵照说明书,以免带来不必要的用药错误。
还有哪些化疗药物能引起心脏毒性?
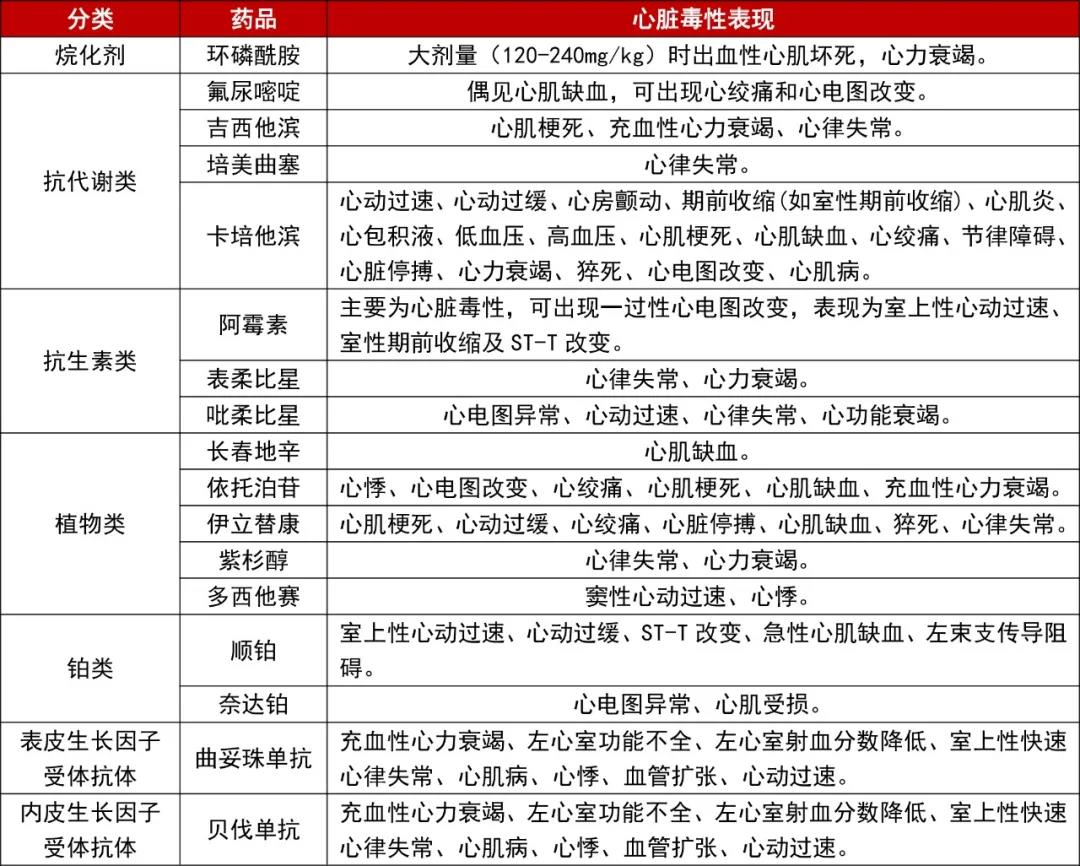
将具有心脏毒性的化疗药物分类并总结如下表。
表1 化疗药物的心脏毒性
紫杉醇注射液、紫杉醇脂质体
和白蛋白紫杉醇的区别?
病例中患者使用的是紫杉醇注射液,虽然紫杉醇抗肿瘤活性好,但是与其他抗肿瘤药物一样,对药物作用部位选择性差,对正常细胞的识别能力弱。由于其水溶性差,需加入聚氧乙烯蓖麻油(Cremophor EL)助溶。
Cremophor EL可以使肥大细胞脱颗粒,释放组胺,或激活补体导致严重的不良反应,如过敏反应和神经毒性。故注射液使用前需要进行脱敏处理。Cremophor EL还可在血液中形成微小颗粒包裹紫杉醇分子,影响药物分子向组织扩散,影响抗肿瘤效应。
目前,使用非助溶剂的新型载体对紫杉醇进行载药已经获得初步成果,包括紫杉醇脂质体和注射用白蛋白紫杉醇。
紫杉醇脂质体
紫杉醇脂质体改变了紫杉醇的溶媒,避免聚氧乙基代蓖麻油复合溶媒带来的毒副作用。它是将药物包封于类脂质双分子层内而形成的微型泡囊体,药物粉末包埋在脂质体微粒中。
这种微粒具有类细胞结构,进入人体内主要被网状内皮系统吞噬而激活机体的自身免疫功能。并改变被包封药物的体内分布,使药物主要在肝、脾、肺和骨髓等组织器官中积蓄,从而提高药物的治疗指数,减少药物的治疗剂量和降低药物的毒性,提高患者耐受性。
注射用白蛋白紫杉醇
注射用白蛋白紫杉醇是由紫杉醇和白蛋白结合成的纳米颗粒全新的紫杉醇制剂,与白蛋白结合的紫杉醇颗粒平均直径130nm。白蛋白紫杉醇利用白蛋白作为人体疏水性分子的自然载体的生物特性增加了药物在肿瘤细胞中的分布,减少了使用聚氧乙烯蓖麻油等有机溶剂引起的过敏反应。
故用药前不需要预防过敏反应的预处理治疗,同时提高了紫杉醇的最大耐受剂量和在人体中的吸收、转运及药物利用度,缩短滴注时间。
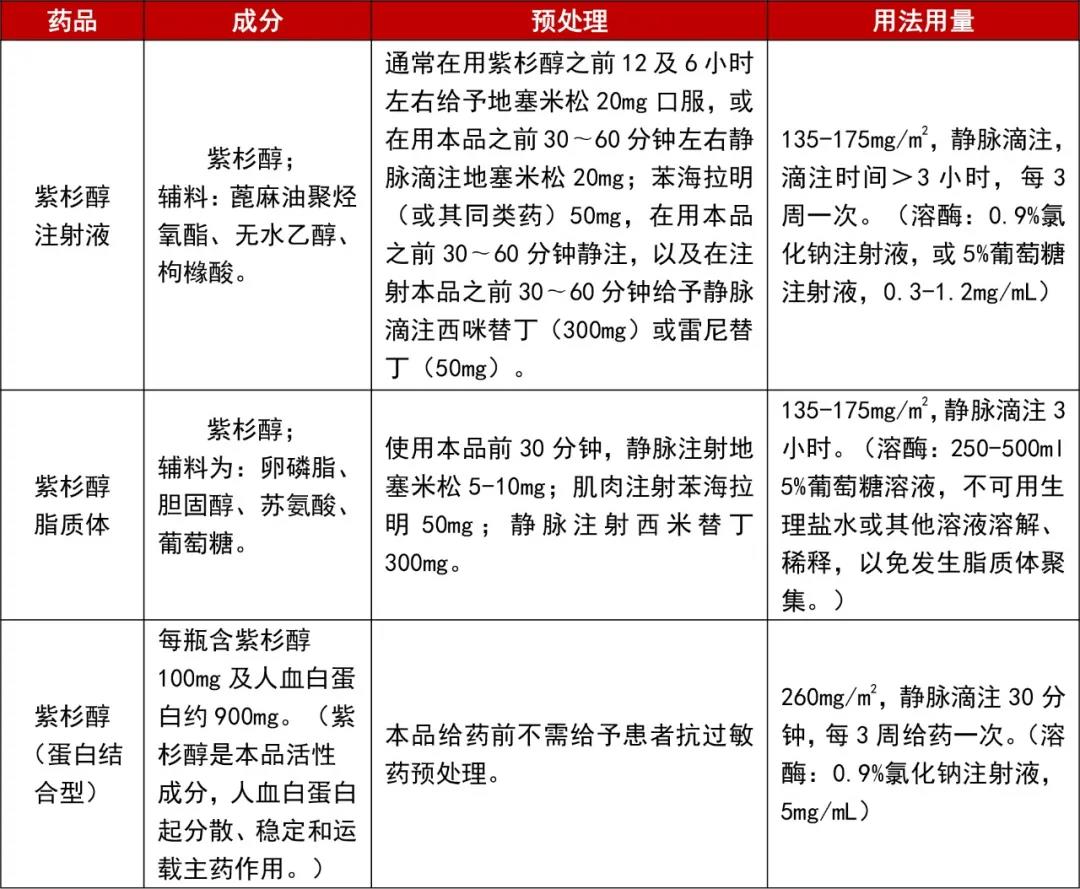
紫杉醇注射液、紫杉醇脂质体和白蛋白紫杉醇的预处理及用法用量比较整理如下表。
表2 紫杉醇不同载体的预处理和用法用量比较
抗肿瘤药物引起心脏毒性的防治
美国心脏评估委员会将抗肿瘤药的心脏毒性定义如下:
(1) 表现为整体功能或室间隔运动明显降低的心肌病,左心室射血分数降低。
(2) 充血性心力衰竭(CHF)相关症状。
(3) 第3心音奔马律、心动过速等CHF相关体征。
(4) 左心室射血分数(LVEF)较基线降低≥5%且绝对值<55%,伴CHF症状或体征;或LVEF降低≥10%且绝对值<55%,无症状或体征;满足其中1项即可诊断。
抗肿瘤药物诱发的心脏毒性包括左心室功能障碍、心律失常、冠状动脉疾病、瓣膜病,这些疾病可进一步发展为心力衰竭。
抗肿瘤药物心脏毒性及机制
可诱发心脏毒性的抗肿瘤药物主要有蒽环类药物、烷化剂、抗细胞微管剂、抗代谢类、单克隆抗体、小分子酪氨酸激酶抑制剂等。
1.蒽环类药物
蒽环类药物引起心脏毒性的主要机制是铁介导的活性氧簇的产生及促进心肌的氧化应激。蒽环类药物螯合铁离子后触发氧自由基,尤其是羟自由基的生成,导致心肌细胞膜脂质过氧化和心肌线粒体DNA的损伤等。
2.烷化剂
烷化剂主要包括环磷酰胺、异环磷酰胺。这类药物与带负电荷的DNA位点结合,引起DNA链断裂和交联,改变肿瘤细胞结构和功能,抑制其增殖。
烷化剂的心肌毒性机制主要与毒性代谢物引起内皮细胞损伤和DNA碱基烷基化可损伤DNA复制和转录过程等有关。
3.铂类
顺铂的心脏毒性多表现为心动过缓、心功能障碍。其产生机制主要与细胞毒作用、氧化应激和炎症有关。
4.抗细胞微管剂
此类药物的心脏毒性常表现为心律失常,亦有少数病例发生血栓、心肌缺血、CHF、心肌梗死。紫杉醇引起心律失常可能与大量的组胺释放,其影响心脏的自主节律及心脏传导有关。
5.抗代谢类药物
氟尿嘧啶类的心脏毒性仅次于蒽环类,最常表现为胸痛,亦可出现心律失常、无症状性心电图变,偶有心肌炎、心力衰竭,严重者可出现心源性休克和猝死。
其发生可能与药物导致冠状动脉血管痉挛、药物直接损伤血管内皮细胞,以及具有心脏毒性的代谢物直接损伤心肌细胞有关。
6.靶向药物
曲妥珠单抗的心脏毒性多表现为无症状性LVEF下降,少数为CHF。曲妥珠单抗心脏毒性发生率与使用药物时间呈正相关,且联合紫杉醇类、蒽环类药物化疗组、高龄组、合并代谢性基础疾病组发病率均较单用曲妥珠单抗组高。
贝伐珠单抗的心脏毒性主要有高血压、CHF,少数会发生心肌梗死。高血压为其最常见的心脏毒性反应,可发生在治疗过程中的任何阶段,且与剂量相关。
心脏毒性的检测
积极、有效地监测患者的心脏功能变化,有助于指导临床用药、优化治疗方案(化疗/靶向药物、剂量强度和密度等),在不影响抗肿瘤疗效的同时,尽可能地使心脏毒性的发生率和程度降到最低。
目前,监测心脏毒性的方法很多,包括心电图、超声心动图、心内膜心肌活检、生化标记物等。
心脏毒性的预防
优化方案:控制药物剂量,如多柔比星累积剂量<550mg/m2,表柔比星累积剂量<900mg/m2。改变给药途径,如持续静脉输注阿霉素96h较静脉推注产生的心脏毒性显著降低,且不影响疗效。改变药物类型,如脂质体多柔比星可有效降低心脏毒性。
右丙亚胺(DZR)是唯一可以有效预防蒽环类药物所致心脏毒性的药物。为了有效预防蒽环类药物导致的心脏毒性,应在第1次使用蒽环类药物前就联合使用右丙亚胺,右丙亚胺与蒽环的剂量比为10-20:1。
右丙亚胺用专用溶媒乳酸钠配置后,再用0.9%氯化钠或5%葡萄糖注射液稀释至200ml,快速静脉输注,30分钟内滴完,滴完后即刻给予蒽环类药物。
心脏毒性的治疗
美国《ACC/AHA成人慢眭心力衰竭诊断治疗指南》中,建议大多数的心力衰竭病人需要常规应用3类药物:血管紧张素转化酶(ACE)抑制剂、血管紧张素受体拮抗剂(ARB)和β-受体阻滞剂治疗。
因为蒽环类药物引起的心衰/心肌病伴有快速性心律失常,在治疗蒽环类药物引起的心衰中,临床上通常使用β-受体阻滞剂对症治疗。
其他的心脏保护剂,包括辅酶Q10、左卡尼汀、N-乙酰半胱氨酸、抗氧化剂以及其他的铁螯合剂(如去铁敏和EDTA)等,或许也具有一定的心脏保护效果,但是用于防治蒽环类药物所致心脏毒性尚需进一步研究。
Meta分析显示辅酶Q10、左卡尼汀、N-乙酰半胱氨酸等对于蒽环类化疗没有明显的心脏保护作用,只有右丙亚胺可使病人明显获益,心衰的发生率明显降低。