罗氏公司已宣布,美国食品药品监督管理局(FDA)已正式批准Actemra在重症肺炎COVID-19患者中进行的3期临床试验,这些患者已因肺炎住院。
Actemra(tocilizumab)是一种白介素6抑制剂,已在中国被批准用于治疗感染新型冠状病毒的患者,这些患者已发展为严重的肺损伤并且血液中的IL-6水平升高。
先前的研究表明,IL-6升高(炎症和高水平免疫反应的生物标志物)与社区获得性肺炎患者的较高死亡率相关。
对Actemra在COVID-19中的用途的研究基于这样的希望,即该药物可以中断“细胞因子释放综合症”(CRS)的过程,这种现象是一种严重的炎症反应,可以作为某些感染的并发症而发生。
它首先被FDA批准用作类风湿性关节炎的治疗方法,随后也被批准用于青少年特发性关节炎,巨细胞性动脉炎和与CAR-T细胞疗法相关的癌症的CRS。
罗氏本月初宣布了与美国生物医学高级研究与开发管理局(BARDA)合作进行COVID-19患者药物评估的意向。
该公司还承诺向美国战略国家储备中心提供10,000瓶Actemra,以备将来使用,并表示已与分销商合作管理产品供应。
罗氏制药公司首席执行官亚历山大·哈迪说:“我们感谢FDA迅速加快了对该临床试验的批准,以评估在冠状病毒感染后患有肺炎的重症患者中评估Actemra的情况,我们正在努力尽快注册。”基因技术部。
该试验名为COVACTA,将在全球招募约330名患者,预计开始日期为4月初。
主要和次要终点将包括评估患者人群的临床状况,死亡率,机械通气和重症监护病房变量。
尽管已有许多评估Actemra的临床试验在全球范围内进行,但Genentech坚持认为COVACTA的研究至关重要,因为尚无良好对照的研究,且有关COVID-19药物安全性或有效性的公开证据有限。
据悉,赛诺菲(Sanofi)和再生元(Regeneron)也已经启动了一项试验,以评估他们自己的IL-6抑制剂Kevzara(sarilumab)是否具有相同的适应症-已住院的重症COVID-19患者。
Science: 抗击新冠肺炎新操作?《Science》发文称多国开始试用卡介苗预防
![]() 0
2020-03-26
点击查看
0
2020-03-26
点击查看
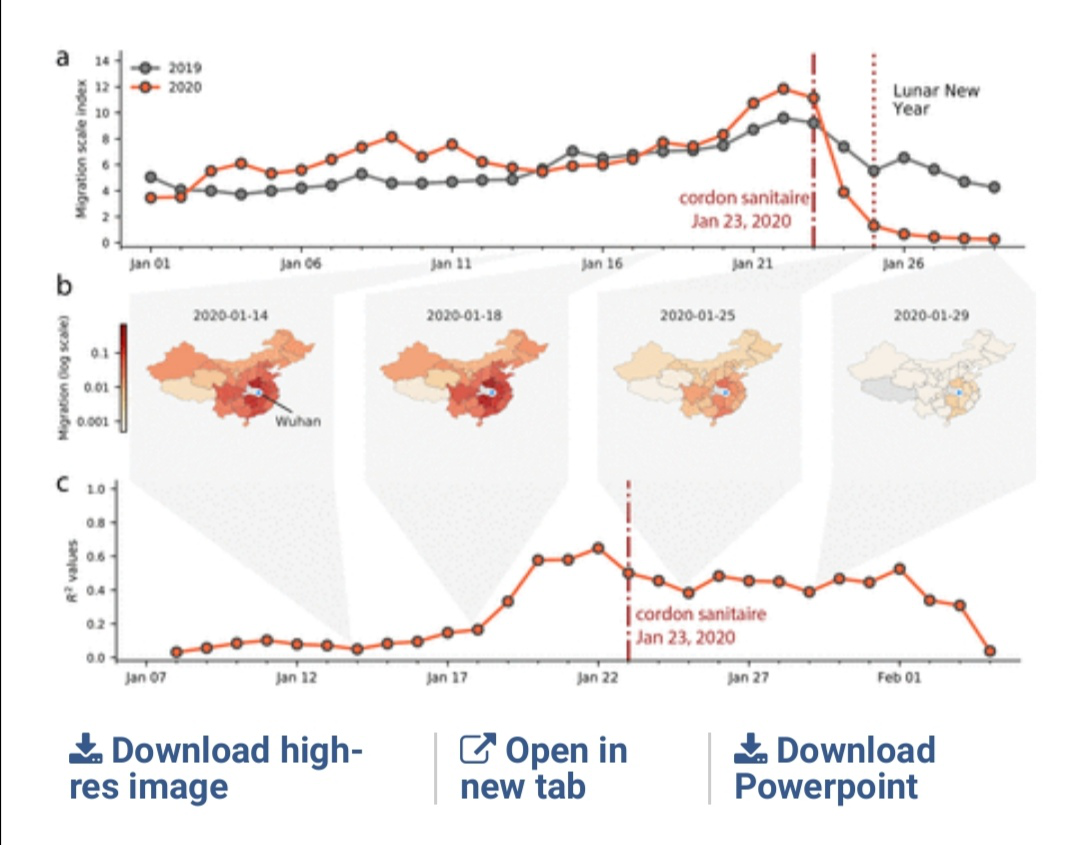
Science:中英联合研究!人口流动和旅行限制的快慢极大程度上影响了疫情的发展
![]() 0
2020-03-26
点击查看
0
2020-03-26
点击查看
Nature:突破:500,000+单细胞的RNA序列揭示所有主要人体器官的细胞类型图
![]() 0
2020-03-26
点击查看
0
2020-03-26
点击查看
3月27日全球新冠肺炎疫情简报,美国确诊数量超过中国,2天新增10万例,全球病例突破53万例
![]() 0
2020-03-27
点击查看
0
2020-03-27
点击查看
纽约急诊科医生公开信:特朗普的冠状病毒计划不仅危险而且致命
![]() 0
2020-03-27
点击查看
0
2020-03-27
点击查看

JAMA Oncol:谢丛华教授发现肿瘤患者感染新冠病毒的风险是普通人群的2.31倍
![]() 0
2020-03-27
点击查看
0
2020-03-27
点击查看
