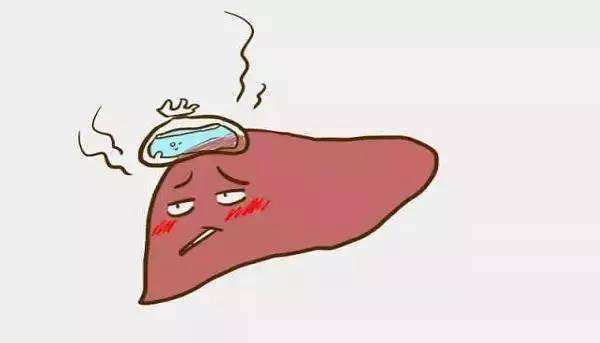
非酒精性脂肪肝病是一类临床-组织病理学疾病,它具有类似酒精性肝损伤的组织学特征,但根据定义其发生于基本没有饮酒史的患者。此类疾病具有一系列组织学表现,轻者表现为不伴炎症或纤维化的肝细胞内脂肪蓄积,重者表现为伴坏死性炎症的肝脂肪变,并且可能伴或不伴纤维化。
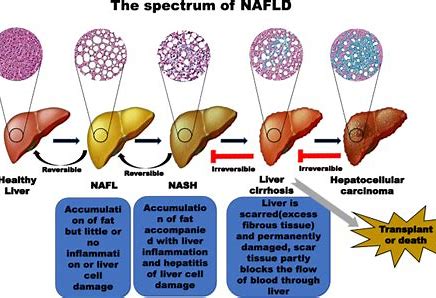
生物制药公司Inventiva今天宣布,美国食品和药品监督管理局(FDA)授予该公司的主要候选药物Lanifibranor治疗非酒精性脂肪性肝炎(NASH)的“突破性疗法称号”。自2015年1月以来,Lanifibranor被认为是首个获得该称号的NASH治疗药物。
lanifibranor是泛PPAR激动剂,在治疗非酒精性脂肪性肝炎(NASH)的2b期临床试验中达到试验的主要终点和多个关键性次要终点。

FDA的“突破性疗法称号”旨在加快针对严重或危及生命的疾病的候选药物的开发和审查。为了获得这一资格,候选药物必须显示出初步的临床疗效,即显示出比现有疗法或安慰剂(如果没有批准的疗法)的实质性改善。
在2020年6月,IIb期临床试验是一项为期24周的临床研究,结果显示,lanifibranor达到了主要终点,显著降低了Steatosis Activity Fibrosis评分(SAF)。此外,lanifibranor也达到了关键的次要终点,包括NASH消退、纤维化无恶化和肝纤维化改善。
NATIVE是一项随机双盲,含安慰剂对照的2b期临床试验,NASH确诊患者接受了两种不同剂量的lanifibranor或安慰剂的治疗。试验结果表明,在这项为期24周的临床试验中,lanifibranor达到试验的主要终点。在接受剂量为1200 mg/day的lanifibranor治疗的意向治疗(ITT)患者群中,评估肝细胞炎症和肝细胞气球样变(hepatocellular ballooning)的SAF评分与基线相比,显著降低(同时肝纤维化程度没有恶化)。Lanifibranor治疗组(1200 mg/day)的患者中49%达到这一终点,安慰剂组的数值为27%(p=0.004)。
同时,lanifibranor还达到多个关键性次要终点,包括在1200 mg/day剂量组中达到改善纤维化至少一级的同时保持NASH症状不恶化。
Inventiva公司表示,基于公布的顶线结果,该公司已决定将这一临床研究项目推进到关键性3期临床阶段。该公司将与FDA和EMA进行讨论,确定相关临床试验的设计。Inventiva同时计划在今年11月的医学会议上汇报这一临床试验结果。
不过,去年Lanifibranor在一个叫做FASST的全身性硬化病二期临床(IIb)失败。这个实验招募145位弥漫性皮肤全身性硬化病("dcSSc")患者,比较一日两次400、600毫克两个剂量Lanifibranor、安慰剂对一个叫做mRSS皮肤指数的改善。结果在标准疗法背景上用药48周三组患者无差异,该试验也错过所有二级终点。
原始出处:
https://www.firstwordpharma.com/node/1764556?tsid=4
J hepatology: 奥贝胆酸对非酒精性脂肪性肝炎患者脂蛋白谱的影响
![]() 0
2019-12-29
点击查看
0
2019-12-29
点击查看

J Hepatology:法尼醇X受体激动剂对非酒精性脂肪性肝炎患者脂蛋白谱的影响
![]() 0
2020-01-29
点击查看
0
2020-01-29
点击查看

J Hepatology: 微生物群导致的肠道血管屏障破坏是非酒精性脂肪性肝炎发展的前提
![]() 0
2020-01-29
点击查看
0
2020-01-29
点击查看
Lancet Gastroen Hepatol:非侵入性高风险非酒精性脂肪性肝炎患者识别方法
![]() 0
2020-02-04
点击查看
0
2020-02-04
点击查看
索马鲁肽挑战NASH初获成功,过半患者NASH消除症状
![]() 0
2020-05-07
点击查看
0
2020-05-07
点击查看
Hepatology: 白细胞介素22可以通过改善嗜中性粒细胞驱动性非酒精性脂肪性肝炎的炎症程度
![]() 0
2020-09-09
点击查看
0
2020-09-09
点击查看