作为全球头号传染性疾病,结核病的致病菌结核分枝杆菌近年来表现出日渐严重的耐药性,耐多药结核甚至极端耐药结核已经成为威胁人类健康的重大挑战。切断致病菌的能量补给“线路”,使其“饥饿致死”,成为一种应对耐药结核的新思路。然而,“摸清”致病菌的能量代谢路径至关重要。近日,南开大学饶子和院士团队联合国内外多家
科研机构开展的一项研究,破解了结核分支杆菌能量代谢的奥秘,为抗击耐药结核的新药研发奠定了重要基础。美国东部时间10月25日下午,该成果论文以研究长文的形式在线发表于国际顶级学术期刊《科学》(Science)上。北京时间26日下午,饶子和院士在南开大学省身楼举办的发布会上介绍了这一重大科学进展。
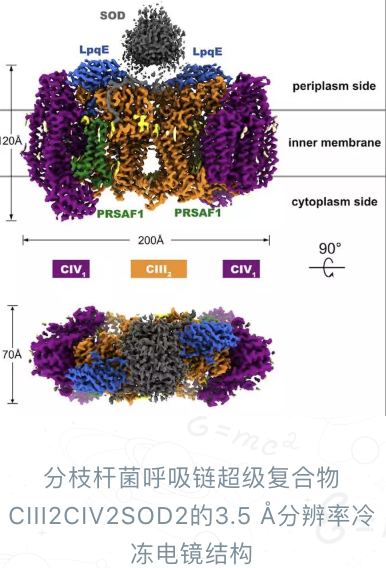
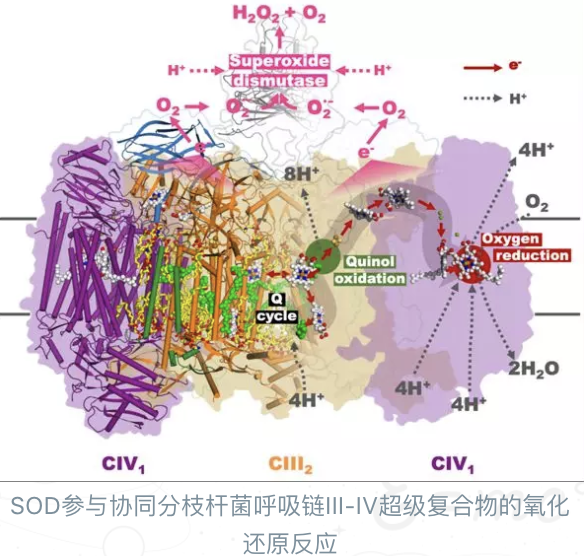
饶子和院士团队的这项工作基于分枝杆菌能量代谢系统呼吸链超级复合物的高分辨率(3.5Å)冷冻电镜结构,揭示了生命体内一种新的醌氧化与氧还原相偶联的电子传递机制。同时,也是首次通过结构生物学的研究,发现超氧化物歧化酶(superoxide dismutase,SOD)直接参与呼吸链系统氧化还原酶超级复合物的组装,并协同工作的现象。
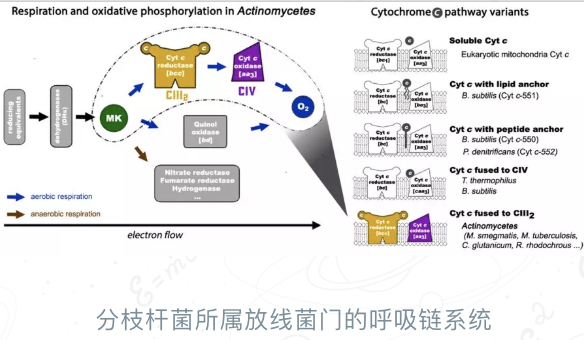
呼吸作用是生命体内最基础的能量代谢活动之一,生命体可以通过呼吸作用将能量物质(糖、氨基酸及脂肪酸等)转化为机体可以直接利用的高能分子三磷酸腺苷(adenosine triphosphate,ATP)。呼吸作用主要由位于微生物细胞质膜或线粒体内膜上的五个大型跨膜复合物:复合物I(NADH脱氢酶)、复合物II(琥珀酸脱氢酶)、复合物III(醌:细胞色素c氧化还原酶)、复合物IV(细胞色素c氧化酶)和复合物V(ATP合成酶),以及两种电子传递载体醌和细胞色素c共同参与完成,被称为呼吸链。其中,由于复合物I-IV通过电子传递实现氧化还原反应的串联,进而产生驱动复合物V中ATP合成的跨膜质子梯度,其又被称为电子传递链。此前研究表明,呼吸链组分可以进一步聚合组装形成超级复合物,促进其之间串联反应的发生,在能量代谢效率和多种生理过程的调控方面具有重要意义。在高等动物中,呼吸链超级复合物的组装失调与多种疾病的发生紧密相关;而在微生物中,呼吸链超级复合物的阻断则是研发药物抑制其扩增、侵染的重要策略。
“复合物III和复合物IV组装形成的超级复合物是生物界较为广泛存在的一种超级复合物形式,特别是对于结核分枝杆菌所属的放线菌门下的多种致病菌的能量供应十分重要。另外,在呼吸链研究方面,此前已报导的高等动物线粒体中复合物I-III-IV形成的“呼吸体”等结构中,复合物III和复合物IV并没有形成广泛的直接相互作用。同时,由于线粒体内细胞色素c蛋白以可溶的游离形式存在,其介导的复合物III到复合物IV之间的电子传递,是在呼吸体等超级复合物内部完成还是跨越多个超级复合物,尚有存疑。我们这个工作,揭示了电子直接从复合物III到复合物IV之间的完整传递路径,以及两个复合物的串联反应机制,是我们团队继2005年在《Cell》杂志首次报道真核线粒体复合物II晶体结构以来,解决的又一个呼吸链领域里大家十分关注,而又一直未解的重要科学问题。”饶子和院士说。
据论文共同第一作者南开大学博士生贡红日、许傲介绍,这项工作的顺利完成是整个团队在结核分枝杆菌多年的研究准备和技术积累的结果。从样品的提纯优化到活性验证,再到冷冻电子显微样品的制备以及数据处理方法的改良,直至最终近原子分辨率分子结构模型的获得,以及后续脂质组学检测、原子吸收光谱测定、电子顺磁共振实验等大量的生物化学和生物物理手段的配合,终于揭开了电子在这个超级复合物内完整传递路径的神秘面纱。
据介绍,这项研究另一个“颇令人意外”的发现是,虽然超氧化物歧化酶(SOD)长久以来从酶学功能上被认为与呼吸链的氧化还原反应具有相关性,特别是与线粒体中以呼吸链为中心的氧化磷酸化系统的自由基清除,以及微生物侵染过程中宿主的
免疫反应都有密切联系,但一直缺乏直接的证据。同时,SOD参与其中的分子机制亦多有争议。
“我们的研究首次以结构生物学的视角,证实了SOD在分枝杆菌细胞周质内与呼吸链复合物间存在直接相互作用,并具有清除潜在自由基、协同氧化还原反应的作用。”研究团队主要成员王权博士和李俊副研究员介绍,更为重要的是这个发现提示这可能是结核分枝杆菌为代表的放线菌在宿主巨噬细胞内抵抗宿主
免疫反应的一种重要机制。这为进一步认识结核分枝杆菌与宿主的相互作用带来了新的启示。
该工作在新药研发方面亦有着重要的意义。据世界卫生组织报道,当前结核病已发展为全球头号
感染性疾病,几十年来异烟肼、利福平等药物组合的长期使用,衍生出日渐严重的菌株耐药问题,耐多药结核甚至极端耐药结核已经成为结核病治疗领域最大的挑战之一。而近年研究表明,靶向能量代谢系统能够显著地克服现有药物的耐药问题,其作为治疗耐药结核病的新型药物靶向系统,日渐受到瞩目。2012年获美国
FDA加速审批通过,并于2018年3月进入我国市场的首个治疗耐多药结核新药贝达喹啉(Bedaquiline)就是作用于呼吸链系统抑制其能量合成,从而达到杀灭结核杆菌治疗耐药结核的目的。
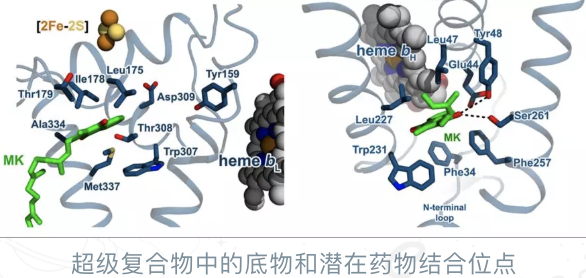
“我们研究的这个复合物是个炙手可热的药物靶标,当前正处于
临床II期的药物分子Telacebec(Q203)正是通过抑制该复合物天然底物的结合,阻断结核杆菌有氧呼吸途径,进而发挥药理作用的。”饶子和院士说。“这项工作对于进一步优化该药物及开发类似甚至更为有效的新药都将起到巨大的推动作用。”参与该工作的南开大学药学院院长杨诚教授补充评价道。
据了解,饶子和院士团队长期致力于我国新发再发传染性疾病病原体相关蛋白质的结构与功能研究,以及创新药物的研发。本研究是继年初疱疹病毒的组装机制后,该研究团队今年在《科学》(Science)上发表的第二篇长文。本论文的共同第一作者为南开大学在读博士生贡红日、许傲和上海科技大学免疫化学研究所李俊副研究员;中国科学院生物物理研究所王权博士、孙飞研究员和饶子和院士为共同通讯作者。南开大学、中国科学院生物物理研究所、上海科技大学为课题的主要牵头单位,清华大学、中国科技大学、中国科学院生物化学与细胞生物学研究所、中国科学院遗传与发育生物学研究所、天津国际生物医药联合研究院、英国牛津大学、澳大利亚昆士兰大学等单位参与了研究。同时,该工作得到了科技部、中国科学院B类战略性先导科技专项、国家自然科学
基金委的项目资助,国家超级计算天津中心和国家蛋白质科学中心(上海)提供了部分技术支持。
原始出处:
来源:南开大学
版权声明:
本网站所有注明“来源:梅斯医学”或“来源:MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有,非经授权,任何媒体、网站或个人不得转载,授权转载时须注明“来源:梅斯医学”。本网所有转载文章系出于传递更多信息之目的,且明确注明来源和作者,不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。同时转载内容不代表本站立场。
在此留言