BCMA和CD19 CAR-T
尽管BCMA CAR-T细胞治疗在复发/难治性多发性骨髓瘤(RRMM)中取得了很高的治疗反应,但单靶点免疫治疗存在原发性耐药和复发的问题,解决该问题的方法之一就是使用双靶点CAR-T细胞,例如BCMA/CD38。
在大多数患者中,CD19在小部分骨髓瘤细胞(10.3-80%)上以超低密度表达,CD19low骨髓瘤细胞可以被抗CD19 CAR-T细胞消灭。此外,在大剂量美法仑和挽救性自体造血干细胞移植(Auto-HSCT)后给予抗CD19 CAR-T细胞在RRMM中也显示出一定疗效。基于此,国内学者曾开展前瞻性研究,证明人源化抗CD19和抗BCMA CAR-T细胞联合输注在RRMM患者中是可行的。
国内学者进一步设计了二代双特异性BC19 CAR,包含抗 BCMA 单链可变片段 (scFv) 和人源化抗CD19 scFv,并于近日在《Nature Communications》发表了双特异性 BC19 CAR-T 细胞的临床前结果和 I/II 期研究中治疗RRMM患者的结局。通讯作者为徐州医科大学附属医院曹江教授、郑骏年教授和徐开林教授。

I/II期研究结果
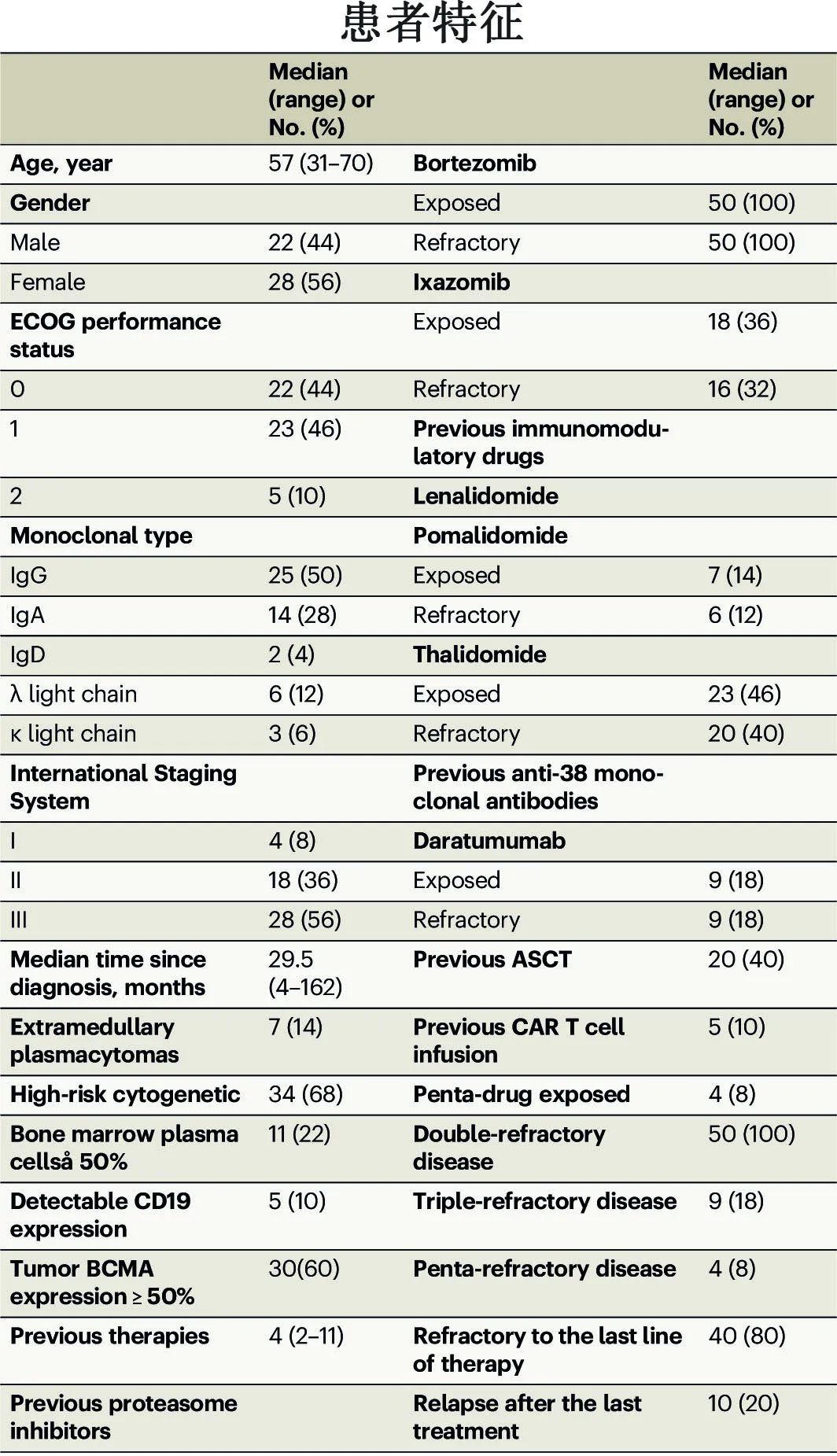
该开放标签、单臂、I/II期研究共筛选了64例患者,其中54例入组,4例患者在输注前因疾病快速进展而退出,最终50例 RRMM 患者接受 BC19 CAR-T 细胞输注。
CAR-T细胞输注后最常见的急性不良事件为血液学毒性和CRS。50例患者均发生血液学不良事件,包括100%的患者中性粒细胞减少症、100%的患者白细胞减少症、94%的患者贫血和88%的患者血小板减少症。3-4级血液学不良事件包括:中性粒细胞减少症(49/50例[98%])、白细胞减少症(48例[96%])、血小板减少症(33例[66%])和贫血(32例[64%])。在接受BC19 CAR-T细胞输注第0天后发生3-4级细胞减少事件的患者中,在第28天恢复到≤2级的比例:白细胞减少(30例[60%])、中性粒细胞减少(27例[54%])、贫血(14例[28%])和血小板减少(8例[16%])。
46例患者(92%)发生CRS, 4例患者8%为≥3级。CRS发作的中位时间为7天,中位持续时间为3天。2例患者(4%)发生1级神经毒性事件,未观察到3-5级神经毒性。6例患者(12%)同时接受托珠单抗和糖皮质激素治疗,19例(38%)患者接受托珠单抗治疗,16例(32%)患者接受糖皮质激素治疗。1例CR患者在2级CRS后第19天出现噬血细胞性淋巴组织细胞症,最终死于感染性休克和胃肠道出血。
除了B细胞再生障碍(aplasia)、低丙球蛋白血症和感染外,晚期不良事件(CAR-T细胞输注后超过3个月)很少。45例患者发生B细胞再生障碍,输注后平均持续时间为138天。CAR-T细胞治疗前20%(10/50)的患者发生低丙球蛋白血症,BC19 CAR-T细胞输注后3个月后51%(23/45)的应答者出现低丙球蛋白血症。49例患者中有14例(29%)在CAR-T细胞输注后超过3个月发生≥3级血细胞减少。
42例(84%)在CAR-T输注后接受G-CSF治疗中性粒细胞减少症。17例(34%)患者因中性粒细胞减少症而接受抗真菌预防治疗,42例(84%)患者接受了抗病毒预防治疗,16例(32%)患者接受抗肺孢子虫预防治疗,随访期间未发现肺孢子虫感染。CAR-T输注后的前三个月有30例(60%)患者发生感染,多为轻中度 (20/30;66.7%)。最常见的微生物为细菌(n=9),其次为真菌(n=3)和病毒(n=1)。在存活超过3个月的49例患者中,19例(39%)在3个月后发生26起感染,其中10例(20%)发生11起重度感染(定义为≥3级)。17例(35%)患者发生肺部感染,1例(2%)患者发生结肠炎。1例(2%)发生带状疱疹,1例(2%)发生菌血症,最终死于菌血症。除1例5级感染外,所有感染均经及时治疗得到控制。
数据截止时,8例患者(16%)在随访期间死亡,4例患者(8%)死于疾病进展或相关并发症。
疗效
46例患者(92%)对BC19 CAR-T细胞达到总体缓解(≥PR),包括18例(36%)sCR,12例(24%)CR, 9例(18%)VGPR和7例(16%)PR,4例(8%)患者SD为最佳缓解。至首次≥PR的中位时间为23.5天,至最佳缓解的中位时间为1.9个月。7例髓外病变患者中有6例(86%)的获得总体缓解。在曾接受过CAR-T细胞治疗的5例患者中,2例达到sCR, 1例达到PR,另外2例为SD。
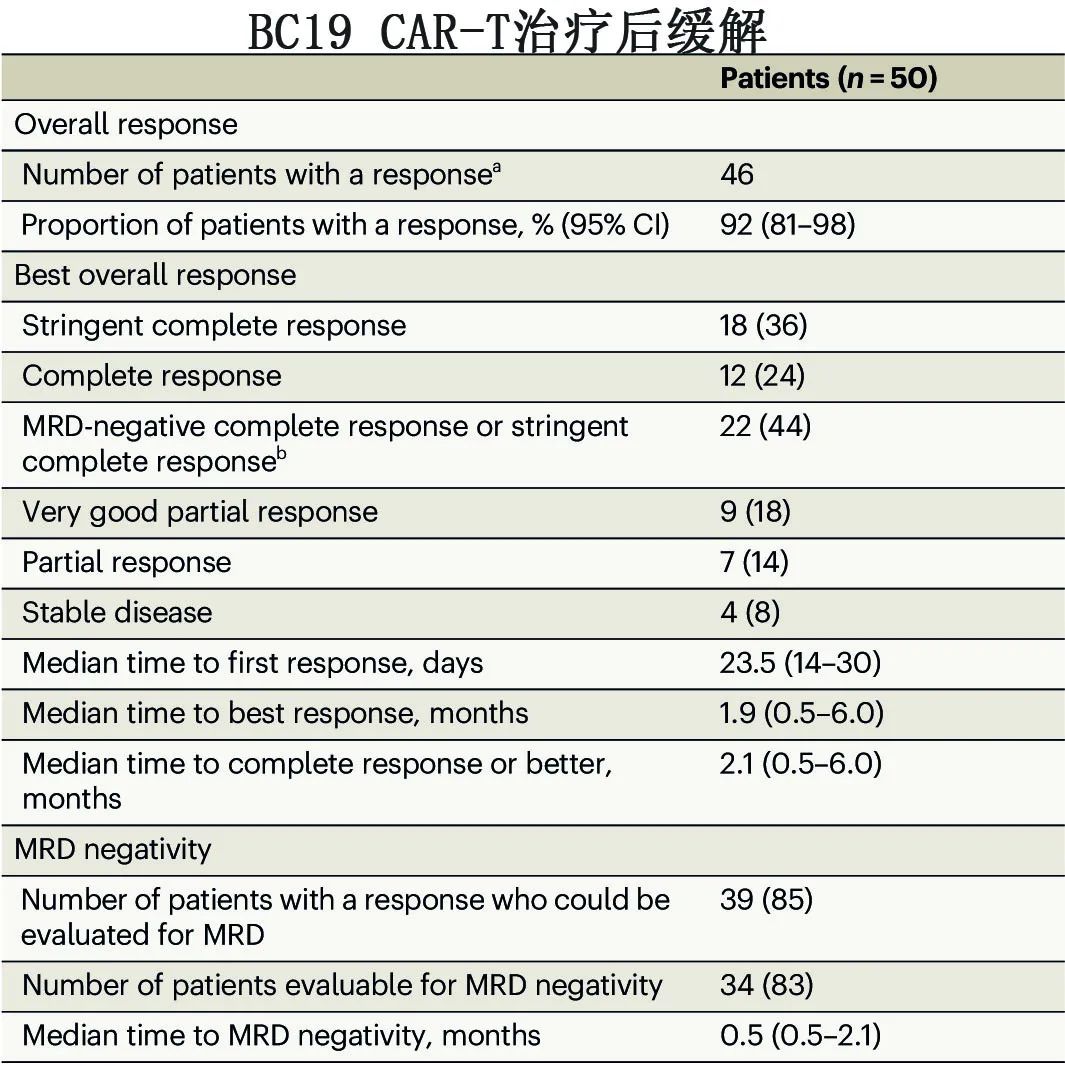
41例进行了MRD检测,其中34例(83%)达到MRD阴性,包括22例CR或sCR(表2)。CAR-T细胞输注后MRD阳性状态变为阴性的患者的中位时间为0.5个月。至MRD阴性时间与缓解深度无关。
单因素分析显示,在关键协变量中ORR一致,包括疾病分期、高危细胞遗传学、髓外病变、基线肿瘤负荷、BCMA表达、CD19检测、既往治疗线数和诊断后时间;但曾接受过CAR-T细胞治疗的患者ORR较低。
中位随访11个月,≥PR的46例患者中有27例(59%) 持续缓解;46例患者中15例(33%)在随访期间出现复发或进展,包括30例≥CR患者中的8例,16例VGPR或PR患者中的7例。
15例复发或进展患者进行了BCMA和CD19检测,其中1例(7%)复发为BCMA阴性骨髓瘤细胞,14例(93%)复发为BCMA阳性骨髓瘤细胞;15例骨髓瘤细胞CD19表达均为阴性。
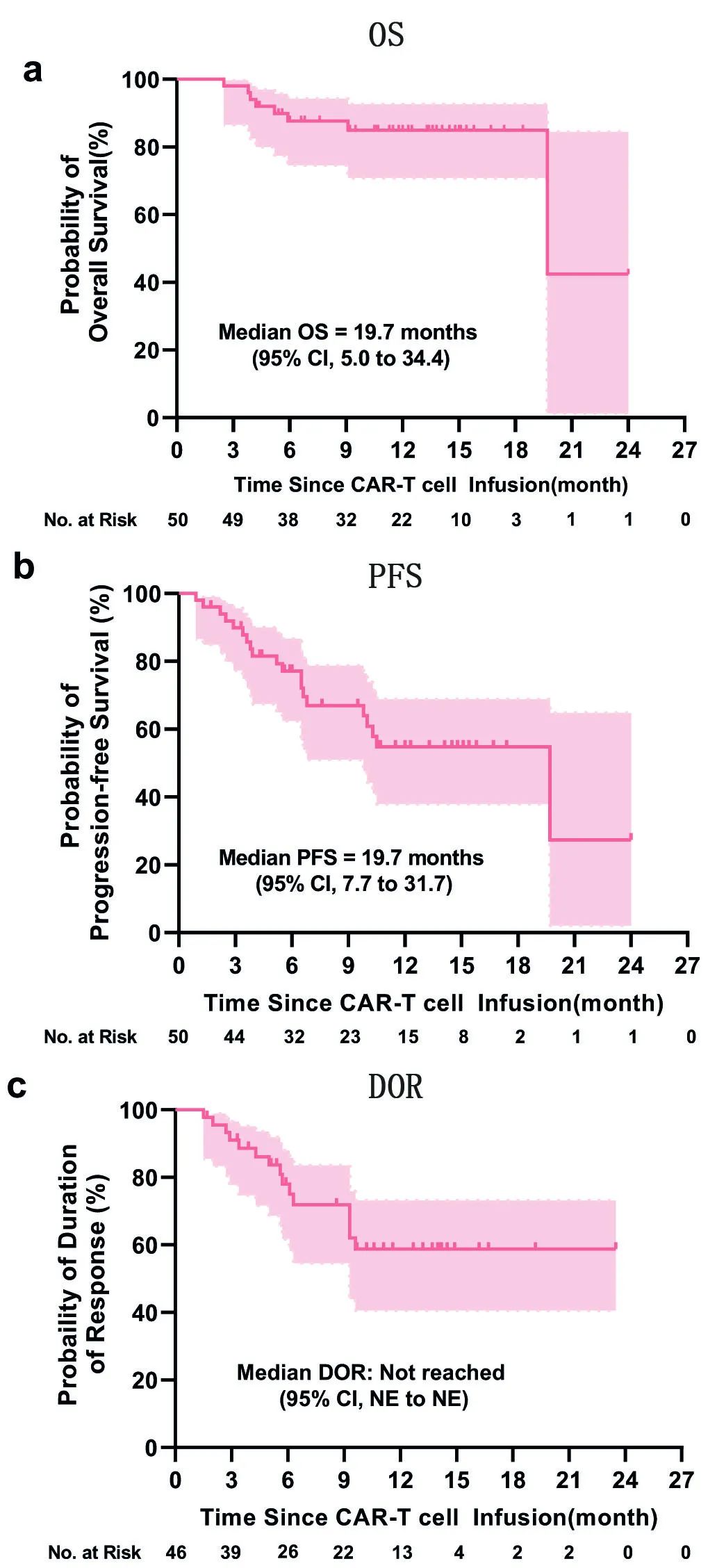
50例患者的中位OS和PFS分别为19.7个月和19.7个月。46例≥PR患者的中位DOR未达到。1年PFS、OS和DOR率分别为55%、85%和59%,而≥CR患者的12个月PFS和OS率分别为66%和90%。
总结
结果耐受性良好,表现出显著的临床疗效。该人群的总缓解率为92%,中位无进展生存期为19.7个月,1年总生存率为85%。8%的患者出现3级或更高级别的细胞因子释放综合征,4%的患者出现1级神经毒性事件,符合预定的主要终点。
总体而言,该研究发现输注 BC19 双特异性 CAR-T 细胞是管理 RRMM 患者的一种可行、安全和有效的策略。还需要更大的样本量和更长的随访时间的前瞻性和多中心研究,以探索BC19 CAR-T细胞治疗对长期结局的影响。
参考文献
Shi, M., Wang, J., Huang, H. et al. Bispecific CAR T cell therapy targeting BCMA and CD19 in relapsed/refractory multiple myeloma: a phase I/II trial. Nat Commun 15, 3371 (2024). https://doi.org/10.1038/s41467-024-47801-8
【BCJ】多发性骨髓瘤每月唑来膦酸治疗超过两年可持续防止骨病进展
![]() 0
2024-04-22
点击查看
0
2024-04-22
点击查看

徐州医科大学郑骏年、曹江团队《自然·通讯》:BCMA/CD19 CAR-T有效治疗难治复发性多发性骨髓瘤!
![]() 0
2024-04-24
点击查看
0
2024-04-24
点击查看

【AJH】KRd对比VRd治疗NDMM的疗效:一项系统回顾和Meta分析
![]() 0
2024-04-23
点击查看
0
2024-04-23
点击查看

Hematology:串联自体造血干细胞移植治疗多发性骨髓瘤——系统回顾和荟萃分析
![]() 0
2024-04-25
点击查看
0
2024-04-25
点击查看

Cancer Med:BCMA CAR-T细胞参与治疗多发性骨髓瘤的有效性和感染并发症——来自瑞典的真实世界证据
![]() 0
2024-04-27
点击查看
0
2024-04-27
点击查看

Clin Exp Med:一种利用单细胞研究预测预后和免疫治疗反应的新型自然杀伤细胞相关模型
![]() 0
2024-04-27
点击查看
0
2024-04-27
点击查看