论坛导读:帕金森病(pakinson's disease,PD)是一种以运动和非运动特征为特征的进行性神经障碍,临床特征与黑质致密部多巴胺缺乏有关,其中遗传和环境因素相互作用导致其病因。通过遗传学方法破译疾病病因已经取得了显著进展,但关于环境和遗传因素如何相互作用以改变外显率、风险和疾病严重程度的数据有限。PD的病因是多因素的,PD的病理生理学涉及各种分子和细胞机制,包括氧化应激、炎症途径、水通道蛋白、生长因子和肠道微生物群。肠道微生物群的变化被认为与PD的运动表型有关。
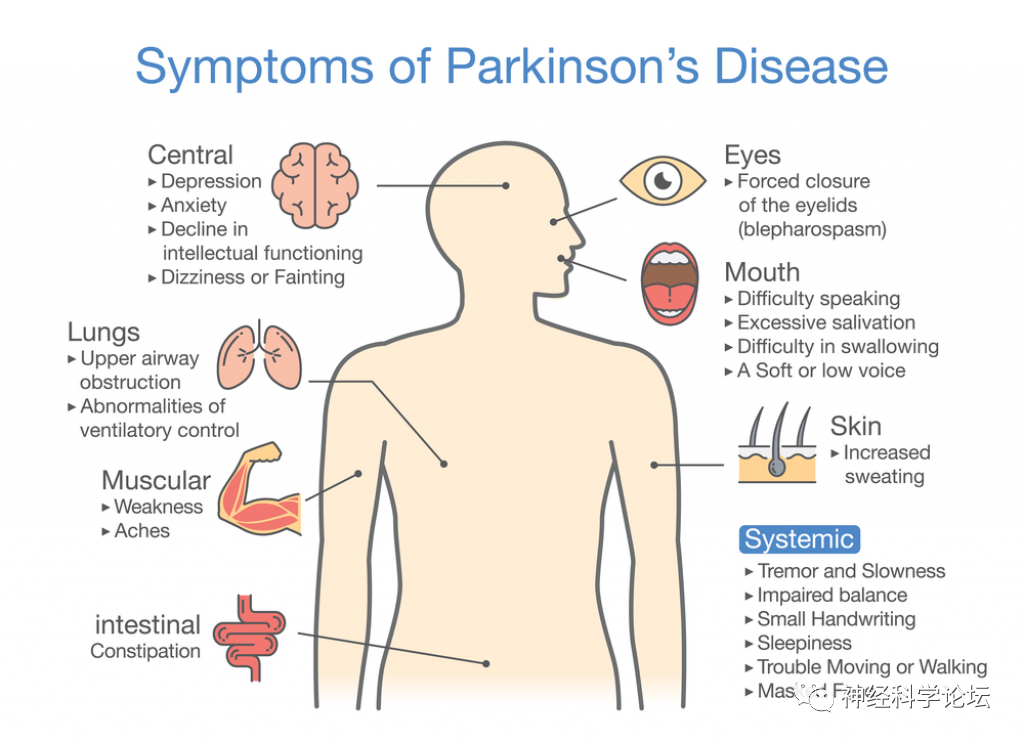
自20世纪90年代以来,帕金森病(pakinson's disease,PD)的全球负担已从250万增加到610万,成为全世界第二大流行的神经退行性疾病。随着世界人口老龄化和寿命延长,这一数字预计将会上升。近几十年来,人们对散发性PD的看法发生了巨大的变化。长期以来,PD被认为是一种以运动障碍为特征的脑部疾病;然而,几个危险因素的鉴定和PD有胃肠道发病的假设提供了额外的线索。今天在认识到前驱非运动症状和驱动其演变的病理过程后,对其他器官系统的参与有了更多的了解。由于这个原因,PD越来越被视为一种多器官和多系统的病理,它是由衰老相关的衰退过程中易感遗传因素与挑战性环境的相互作用引起的。目前一致认为存在帕金森病的诊断前阶段,可分为临床前阶段和前驱期,我们可以在更广泛的帕金森病发病机制背景下更好地定义帕金森病的风险标志物和前驱标志物。
神经病理学标志包括黑质中多巴胺能神经元的缺失、由α-突触核蛋白聚集引起的路易体和路易神经突起的存在以及大脑中的神经炎症。前驱期发生在PD发病前数年,在此期间许多患者表现出胃肠道症状。这些症状支持Braak的理论和模型,即病理性α‐突触核蛋白从肠道传播到大脑。重要的是,免疫反应在帕金森病的发病机理中起决定性作用。小胶质细胞引发的先天免疫反应可导致神经元死亡和疾病进展。此外,T细胞渗入PD患者的大脑,并参与适应性免疫反应。有趣的是,α-突触核蛋白通过直接与小胶质细胞和T细胞相互作用,与先天性和适应性免疫反应相关。
遗传变异,包括从高到低频率变异和从低到高效应大小的变异,至少占患帕金森病总风险的25%。一些PD相关基因的突变表现出不完全外显率或表现出可变性,如发病年龄(AAO)和临床表型。虽然外显率被定义为携带疾病相关基因型的单个个体表现出相关疾病表型的概率,但表达率描述了在具有相同基因型的个体之间观察到的临床表型差异。
年龄增长是帕金森病表现的主要决定因素,但其他因素在影响致病突变的外显率和表达率方面显然也有作用。流行病学和实验研究的发现支持环境因素(“暴露体”)的突出作用,基因和暴露体相互作用的一种方式是通过表观遗传学,这越来越被认为在帕金森病中起着重要作用。家族性帕金森病连锁基因的直接表观遗传调控的证据正在出现,其中研究最多的是SNCA。
各种遗传因素背后的证据,暴露于农药和农业,高乳制品消费,以及已知会增加帕金森病风险的创伤性脑损伤。据观察,体力活动、早期积极的生活方式、高血清尿酸、咖啡因摄入、接触烟草、非甾体抗炎药和钙通道阻滞剂,以及地中海饮食和精神饮食可降低PD风险。这些知识,当与识别高危人群和早期前驱帕金森病患者的方法相结合时,可以帮助临床医生提出实用的建议。
图源:Int J Mol Sci. 2023 May 31;24(11):9547.
PD临床症状可分为运动特征,包括运动迟缓、步态障碍、震颤、强直和言语缺陷;和非运动症状,如抑郁、嗅觉减退、认知障碍、睡眠障碍和便秘。然而,在帕金森病发作之前存在前驱症状阶段,在该阶段人们可能无症状或表现出不属于标准的帕金森病诊断标志物组的其他症状。目前,一些前驱症状与健康人群患帕金森病的高风险有关。PD风险最高的症状之一是特发性快速动眼期(REM)睡眠行为障碍(RBD),并且已经表明80%的特发性RBD个体发展为PD。
PD被认为是异质性的,越来越多的证据表明临床亚组的出现是基于与每种亚型相关的主要症状。与其他PD亚型相比,震颤主导型PD倾向于具有较慢的疾病进展、较轻的衰弱性非运动症状、发生左旋多巴诱发的运动障碍(LID)的可能性降低以及对多巴胺能药物的潜在耐药性。此外,对多巴胺能药物的反应(如果有的话)在静息性和再发性震颤中往往较高,而对动力性震颤的反应相对较差。在死后临床病理学研究中,这种表型构成了高达8%的PD病例。
情感障碍、精神病、行为改变和认知障碍等神经精神症状(NPS)在PD中很常见。其中抑郁症的患病率为38 %。然而,NPS仍然没有得到充分的认识和治疗,往往导致不良后果。它们的流行病学、临床表现、危险因素、神经基础和治疗策略还不完全清楚。虽然心理和社会心理因素可能起作用,但标志性的PD神经病理生理学变化,加上暴露于多巴胺能药物和一些症状发生之间的联系,表明许多NPS的神经生物学基础。
虽然PD的患病率预计会增加,但目前还没有针对帕金森病的预防性或治疗性疗法。尽管营养和饮食是降低慢性疾病风险的可变风险因素,但关于单一营养素对帕金森病影响的研究得出了不同的结果。因此,这种单一营养素的方法可能是不一致背后的驱动力,而整体膳食方法可能通过考虑营养素之间的相互作用来克服这种不一致。一般健康的饮食模式即蛋白质限制饮食(PRD)、生酮饮食(KD)、地中海饮食(MD)和地中海-DASH神经退行性延迟干预(MIND)饮食对PD风险、进展和严重程度的影响。虽然大多数纳入的研究支持饮食和饮食模式在降低帕金森病风险或减轻帕金森病严重程度中的作用,但不一致的结果和对进一步证据的需要使得在提出饮食建议之前进行更多的研究成为必要。
肠道微生物群在大脑发育中具有重要作用。肠道生态失调可能导致辅助性T细胞、促炎细胞因子和脂多糖增加,从而通过微生物群-肠道-脑轴导致肠道和血脑屏障通透性增加。因此,有人认为肠道微生物群可能与神经退行性疾病如阿尔茨海默病和帕金森病的发病机制有关。益生菌是活的微生物,当以足够的量给药时,可以给宿主带来健康益处。益生菌具有公认的抗癌、抗氧化、抗炎和神经保护作用。多种证据表明,益生菌可以控制和改善帕金森病患者和实验动物模型的多种运动和非运动症状。益生菌补充剂通过靶向多种细胞和分子过程,即氧化应激、炎症和抗炎途径以及凋亡,介导这些药理作用。施用益生菌可以提供神经保护,调节肠脑轴。据推测,益生菌可降低神经系统疾病的风险,但这一假设有待系统地解决和证明。表征神经退行性疾病患者补充益生菌后的生化变化将有助于阐明益生菌在治疗PD和其他神经疾病中的潜力。
目前,没有治愈PD的方法,姑息疗法,如左旋多巴给药,旨在缓解运动症状,但随着时间的推移会引起严重的副作用。因此,迫切需要发现新的药物以设计更有效的治疗方法。靶向α-突触核蛋白的分子可以改变导致帕金森氏症的疾病途径,与现有的治疗选择(如左旋多巴和多巴胺激动剂,它们不一定改变疾病途径)相比,可以作为一流的治疗方法。尽管α-突触核蛋白为帕金森病的治疗和诊断发展带来了有希望的好处,但找到解决潜在挑战的方法,如不充分的临床前模型、安全性和有效性,对实现临床转化至关重要。表观遗传改变的证据,如不同miRNAs的失调可能刺激PD发病机制的许多方面,为成功治疗的研究开辟了一个新的场景。由于PD的病理生理学和发病机制是一个复杂的过程,并没有得到很好的理解。然而,目前的临床体征和症状出现在疾病的晚期,并且在该阶段的治疗干预仅缓解那些症状,而不一定抑制疾病的病理途径。因为错误折叠和纤维性颤动与帕金森氏病的早期阶段有关,这使其成为PD诊断和治疗的合适目标。
参考文献
Rajan S, Kaas B. Parkinson's Disease: Risk Factor Modification and Prevention. Semin Neurol. 2022 Oct;42(5):626-638. doi: 10.1055/s-0042-1758780.
Mirzaei H, Sedighi S, Kouchaki E, Barati E, Dadgostar E, Aschner M, Tamtaji OR. Probiotics and the Treatment of Parkinson's Disease: An Update. Cell Mol Neurobiol. 2022 Nov;42(8):2449-2457. doi: 10.1007/s10571-021-01128-w.
Weintraub D, Aarsland D, Biundo R, Dobkin R, Goldman J, Lewis S. Management of psychiatric and cognitive complications in Parkinson's disease. BMJ. 2022 Oct 24;379:e068718.
Zhu B, Yin D, Zhao H, Zhang L. The immunology of Parkinson's disease. Semin Immunopathol. 2022 Sep;44(5):659-672. doi: 10.1007/s00281-022-00947-3.
Costa HN, Esteves AR, Empadinhas N, Cardoso SM. Parkinson's Disease: A Multisystem Disorder. Neurosci Bull. 2023 Jan;39(1):113-124. doi: 10.1007/s12264-022-00934-6.
Knight E, Geetha T, Burnett D, Babu JR. The Role of Diet and Dietary Patterns in Parkinson's Disease. Nutrients. 2022 Oct 25;14(21):4472. doi: 10.3390/nu14214472.
Periñán MT, Brolin K, Bandres-Ciga S, Blauwendraat C, Klein C, Gan-Or Z, Singleton A, Gomez-Garre P, Swanberg M, Mir P, Noyce A. Effect Modification between Genes and Environment and Parkinson's Disease Risk. Ann Neurol. 2022 Nov;92(5):715-724. doi: 10.1002/ana.26467.