HER2 阳性乳腺癌是一种被称为人表皮生长因子受体 2(HER2)的蛋白质检测呈阳性的乳腺癌。这种蛋白质对癌细胞的生长有促进作用。HER2 阳性乳腺癌通常比其他类型的乳腺癌更具侵袭性。
阿斯利康(AstraZeneca)和第一三共(Daiichi Sankyo)近日宣布,FDA 已批准 Enhertu(曲妥珠单抗-deruxtecan)用于治疗患有不可切除或转移性 HER2 阳性乳腺癌患者。两家公司指出,该决定将抗体-药物偶联物 Enhertu 的适应症扩大到早期治疗线。
具体而言,Enhertu 已被批准用于治疗患有不可切除或转移性 HER2 阳性乳腺癌成人患者,这些患者在转移性环境中或在新辅助或辅助环境中接受过基于抗 HER2 的方案,并且在治疗期间或在完成治疗后六个月内出现疾病复发。阿斯利康肿瘤业务部门执行副总裁 Dave Fredrickson 说:“我们很高兴通过这项批准,美国的患者现在可以在治疗早期使用 Enhertu”。
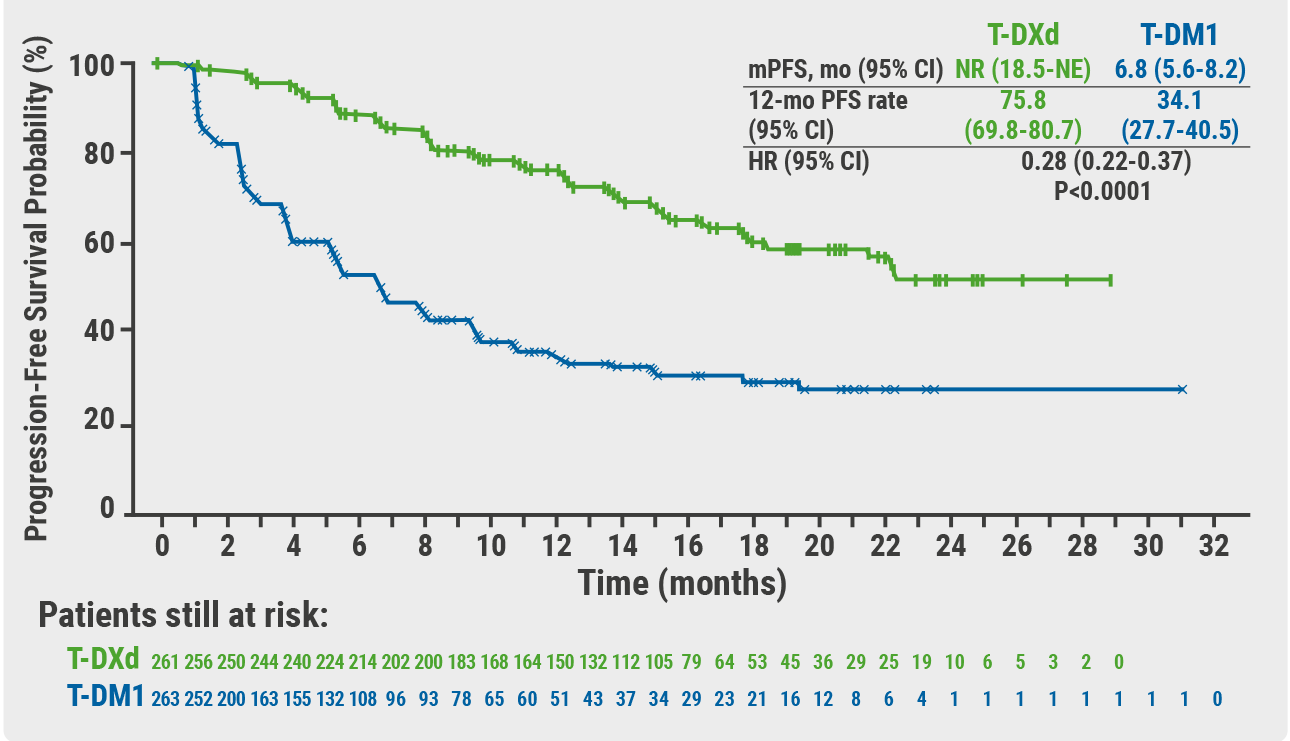
最初的加速批准得到了单臂 II 期 DESTINY-Breast01 试验数据的支持,其中 Enhertu 组患者的总体缓解率为 60.3%,包括 4.3% 的完全缓解率和 56% 的部分缓解率。III 期 DESTINY-Breast03 研究的结果显示,与罗氏的 Kadcyla(曲妥珠单抗 emtansine)相比,Enhertu 在 HER2 阳性不可切除和/或转移性患者中将疾病进展或死亡风险降低了 72% 。
两家公司指出,新的批准是根据 FDA 的实时肿瘤学审查(RTOR)计划授予的,而该申请也通过 Orbis 项目进行评估,澳大利亚、巴西、加拿大、以色列和瑞士的监管机构通过 Orbis 项目进行合作审查。
原始出处:
https://firstwordpharma.com/story/5564019
2022CSCO:殷永梅教授:HER-2阳性乳腺癌诊疗指南3大更新要点
![]() 0
2022-04-23
点击查看
0
2022-04-23
点击查看

JCEM:肥胖与乳腺癌风险
![]() 0
2022-04-24
点击查看
0
2022-04-24
点击查看

Br J Cancer:乳腺癌中的钠离子浓度可预测肿瘤的恶性程度和治疗反应
![]() 0
2022-04-28
点击查看
0
2022-04-28
点击查看

JCO:基于电子化患者报告结局(ePRO)监测与自动化管理干预提醒的数字化乳腺癌病程管理(eRAPID研究)
![]() 0
2022-04-29
点击查看
0
2022-04-29
点击查看

Rhizen Pharmaceuticals AG在2022年欧洲肿瘤内科学会乳腺癌会议上公布一项进行中的Tenalisib (RP6530)治疗局部晚期或转移性乳腺癌患者II期研究的中期积极数据
![]() 0
2022-05-06
点击查看
0
2022-05-06
点击查看

超50万国人11年前瞻研究:喝奶致癌是真的?!其中每天多喝50g,这3种癌风险就多上升超10%!
![]() 0
2022-05-09
点击查看
0
2022-05-09
点击查看
