钙粘素(cadherin, 钙粘蛋白,钙粘合素) 是一类依赖于 Ca2+ 的细胞粘附分子的超家族,它在维持组织结构和形态中发挥着关键作用。Cadherins至少有六个亚家族,包括典型Cadherin、非典型Cadherin、desmocollins、desmogleins、protocadherin type和其他。Cadherin的表达失调往往与疾病有关,包括组织发育不良、肿瘤形成和转移。典型Cadherin胞外域由5个重复序列构成;胞内域由150-160个氨基酸组成,高度保守。
CDH17(Cadherin 17,LI-cadherin),也称为肝肠钙粘蛋白,是钙依赖性蛋白质CDH超家族的非经典成员。CDH17序列由七个细胞外钙粘蛋白结构域和一个非常短的细胞质结构域形成。与其他经典的钙粘蛋白不同,CDH17是一种钙依赖性跨膜糖蛋白,可介导细胞在肠上皮中的细胞粘附。

图1.钙粘蛋白-17 (CDH17) 的结构特征
(即在细胞外氨基末端 (NH2) 具有 7 个钙粘蛋白重复序列(EC1-EC7),随后是跨膜区和羧基处的短胞质结构域-终点(COOH)。钙离子(用红点表示)位于哺乳动物 CDH17 的钙粘蛋白重复序列之间)
CDH17仅在人肠道和胰腺导管上皮细胞中表达,在健康的成人肝脏和胃组织中沉默,在胃肠道恶性肿瘤(包括肝细胞癌,胰腺癌和结直肠癌)中表达异常,因此,可以作为消化系统恶性肿瘤的诊断潜在标志物。
1、CDH17在肿瘤中的作用机制
目前研究发现,CDH17在胃癌、结直肠癌、肝癌、胰腺癌和胆管癌等多种肿瘤组织中均有不同程度的表达,CDH17的高水平表达与患者预后和风险评估密切相关。
CDH17作为钙黏蛋白超家族中的独特一员,在多种疾病中均发现CDH17的异常表达。研究揭示CDH17的功能紊乱与肿瘤细胞的外周浸润及转移关系密切,对肿瘤的复发及患者的生存率均有影响。然而,目前对于CDH17与肿瘤相关作用机制尚未阐明。
肝细胞癌中,CDH17能与E-cadherin结合调控细胞的黏附,以及CDH17胞内衔接蛋白Galectin-3通过在细胞核中与β-catenin结合参与典型Wnt信号传导,这表明CDH17参与Wnt信号的激活。
另有研究结果表明,CDH17过表达能够激活人胃癌细胞MGC-803的MAPK信号通路,促进细胞在体内的致瘤性。
此外,CDH17也被证明能与α2β1整合素相互作用,并且是α2β1整合素活性调控细胞粘附和增殖的关键决定因素,以及能促进结肠直肠癌细胞获得肝转移的能力。

CDH17在肿瘤中的作用机制以及在癌症治疗中的具体作用虽然尚未清楚,但已经有新型靶向治疗药物(如BI 905711和ARB102等)处于临床研究阶段,用于治疗胃癌、胰腺癌、食管癌、胆管癌等胃肠道癌。这些药物可同时结合肿瘤细胞表面的CDH17和死亡受体TRAILR2,诱导肿瘤细胞凋亡,对表达CDH17的正常细胞无损伤。
2、目前在研格局
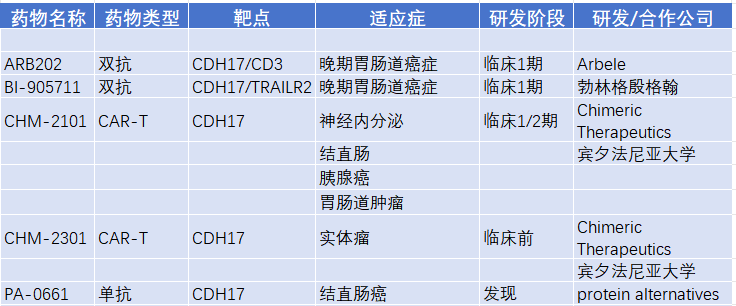
ARB202
ARB202是利用TriAx技术构建的一种人源化抗CDH17xCD3的IgG4双抗, 是一款潜在“同类首创”药物,其具备独特亲和力抗 CDH17 和抗 CD3 差异化的结构,在保证高特异性和高杀伤活性的同时,避免过度激活T细胞所引起的全身免疫反应风险。
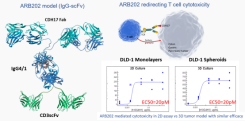
Arbele的TriAx抗体设计是为了通过结合多种抗肿瘤机制在消化道癌症治疗中获得更大的疗效,具有低抗原性、稳定性、理想的生物分布和药代动力学特性。纳入TriAx抗体的抗肿瘤机制包括重新引导T/NK细胞的细胞毒性,抑制免疫检查点,吞噬作用和增强适应性免疫反应。

2022年 3 月 31 日,香港科学园生物科技公司艾贝乐 (ARBELE) 研发的创新药物ARB202 双抗临床试验申请获得澳洲TGA批准,用于治疗晚期胃肠道恶性肿瘤。这是全球唯一获批临床的CDH17xCD3双抗特异抗体。
2023年8月2日,Arbele公司在ASCO突破性会议上公布了其首款CDH17xCD3双特异性T细胞参与抗体ARB 202的早期安全性数据,该药品曾在2022年8月在澳大利亚完成I期首次临床试验首例患者给药。
BI-905711
BI905711是勃林格殷格翰公司首创的双特异性、四价治疗性抗体,靶向TRAILR2和CDH17的四价双抗,TRAILR2与CDH17交联诱导CDH17依赖性TRAILR2聚集,在共表达TRAILR2和CDH17的肿瘤细胞中诱导选择性凋亡。

目前BI905711针对晚期难治性消化道癌症的Ia/Ib期研究(NCT04137289)正在患者招募中。
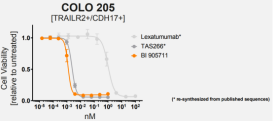
此前在临床前试验结果表明,在CDH17/TRAILR2共表达的COLO 205细胞中,BI 905711与第一代TRAILR2激动剂lexatumumab相比,细胞活力抑制作用强约1000倍。
在体内结直肠癌异种移植模型中,单次给药后肿瘤持续消退长达约30天。并且没有观察到肝脏毒性。
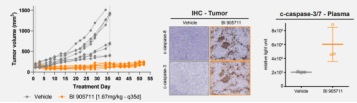
在CRC患者来源的异种移植肿瘤模型中,BI 905711也显示出显著的抗肿瘤效果。

今年ESMO年会上,公布的I期治疗胃肠道肿瘤数据显示,入组45例患者,观察到12例SD,同时安全性良好。
CHM-2101
CHM 2101 (CDH17 CAR T) 是世界知名的宾夕法尼亚大学细胞治疗中心发明的同类首创第三代 CDH17 CAR T,具有CD28和4-1BB共刺激结构域。CHM 2101的临床前证据于2022年3月发表在《Nature Cancer》杂志上,证明在7种癌症中完全根除肿瘤。
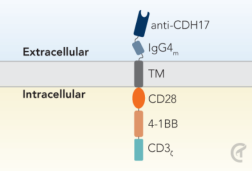
CDH17 CAR-T细胞仅浸润肿瘤细胞,尽管正常细胞表达CDH17也不受影响。在正常细胞中,CDH17隐藏在正常细胞屏障的紧密连接之下;而在癌症中,CDH17上调导致其暴露在癌细胞膜上,允许CAR-T检测并结合它。

临床前证据表明,CHM-2101具有完全根除肿瘤细胞而不复发的实体肿瘤的独特效力,并对正常组织没有毒性。
2023年10月31日,Chimeric Therapeutics宣布,美国FDA已经批准其CDH17靶向CAR-T细胞疗法的研究新药(IND)申请,未来将计划在2024年开展一项针对晚期结肠直肠癌、胃癌和神经内分泌肿瘤患者的多中心、开放标签1A/B期临床试验中研究CHM 2101
PA-0661
2020年9月10日勃林格殷格翰,宣布双特异性和四价治疗性抗体BI 905711进入针对晚期胃肠道(GI)癌症患者的首次人体临床试验。
同类首创的 BI 905711 抗体旨在识别促凋亡肿瘤坏死因子 (TNF) 相关的凋亡诱导配体受体 2 (TRAILR2) 和肿瘤细胞锚定钙粘蛋白 17 (CDH17),以激活主要存在于胃肠道中的共表达肿瘤细胞中的自毁(凋亡)通路。
对于患有这些类型癌症的患者来说,1期试验的进展标志着继续开发更可耐受的创新疗法以解决高度未满足需求的疾病的一个重要里程碑。
可以看出,CDH17的药物市场布局面相当广阔,期待未来一段时期内会有好进展出现。
攻克实体瘤一直是人类努力的方向,CDH17可能代表了一类新的更加安全的药物开发靶点,对未来的细胞疗法尤其是CAR细胞治疗有一定启示。
参考资料: