CD19 CAR-T的组织学差异
CD19 CAR-T是B细胞淋巴瘤的革命性治疗方法,CAR-T细胞扩增是其发挥功能所必需的,但也与毒性相关。早期毒性包括细胞因子释放综合征(CRS)、免疫效应细胞相关神经毒性综合征(ICANS)和免疫效应细胞相关噬血细胞性淋巴组织细胞增生样综合征(IEC-HS),晚期毒性包括长期血细胞减少和感染。虽然CAR-T细胞疗法越来越常见,但CAR扩增在驱动生存和毒性终点方面的作用仍不明确,但CAR扩增与CRS、ICANS和长期血细胞减少(尤其是在B细胞再生障碍)具有相关性。
为了解CD19 CAR-T扩增对输注后1个月内患者结局的影响,斯坦福大学专家前瞻性研究了单中心接受CD19 CAR-T治疗的236例患者。研究结果近日发表于《Blood Advances》。

要点
1、与大B细胞淋巴瘤或滤泡性淋巴瘤相比,套细胞淋巴瘤的CD19 CAR-T扩增和毒性均较高。
2、大B细胞淋巴瘤中CD19 CAR-T扩增与毒性相关,但与疗效无关。
研究结果
患者特征
该前瞻性研究纳入斯坦福大学接受axicabtagene ciloleucel (axi-cel)或brexucabtagene autoleucel (brex -cel)治疗的236例患者(表1)。
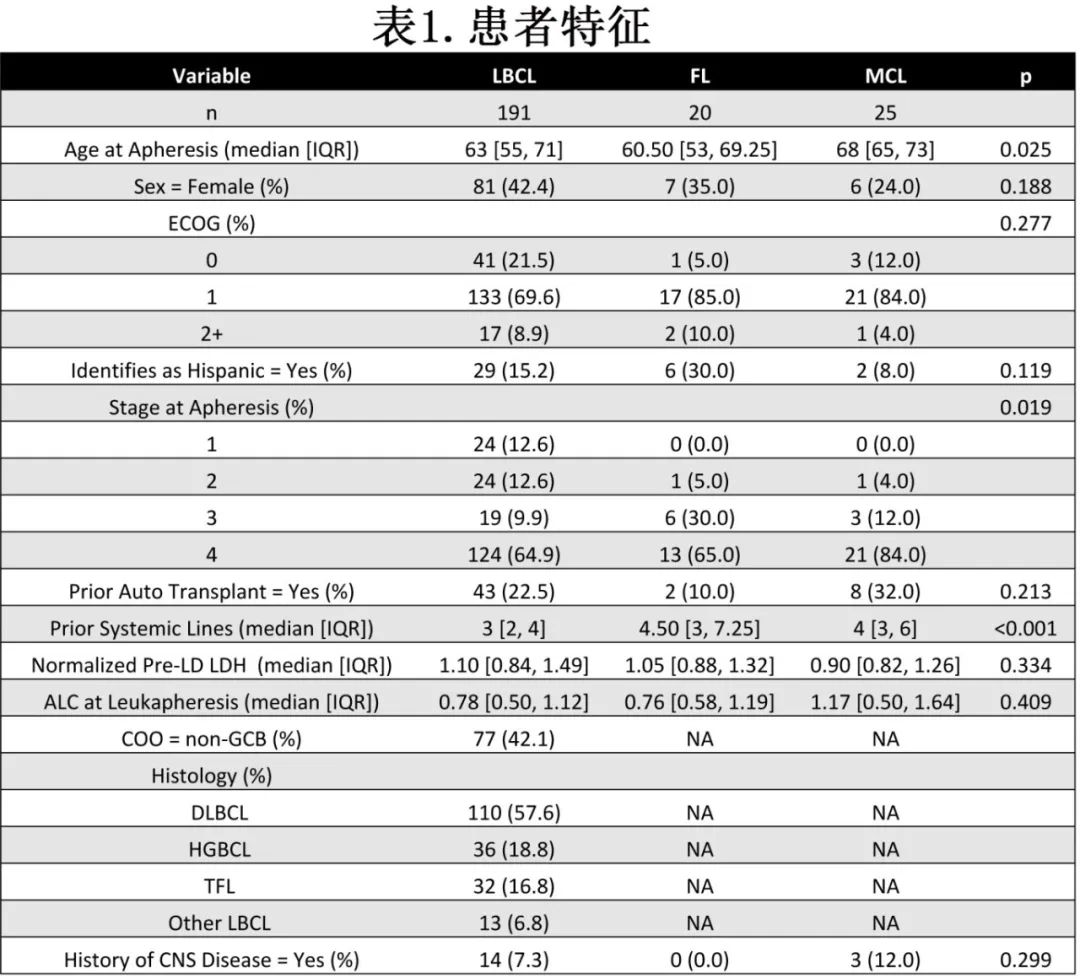
研究包括接受axi-cel治疗的191例LBCL患者,接受axi-cel治疗的20例FL患者,以及接受brex-cel治疗的25例MCL患者。191例LBCL患者中,11例(5.75%)为二线治疗。98%的患者作为标准治疗。根据Kaplan - Meier曲线确定的中位随访时间,LBCL队列为23.85个月,FL队列为14.65个月,MCL队列为13.27个月。12个月PFS、TTP和OS分别为:LBCL为50.9%、53.15%、75.27%,FL为87.1%、95%、87.1%,MCL为66.9%、69.8%、92%(表1,图1A-B),与ZUMA-1、ZUMA-7、ZUMA-2和ZUMA-5研究的结果相似。感染和第二恶性肿瘤导致的死亡是CD19 CAR-T的重要课题。在整个队列的116个PFS事件中,15个是由于非复发死亡,包括12个归因于感染和3个归因于第二恶性肿瘤。
三组患者的中位年龄(LBCL组63.0岁,FL组60.5岁,MCL组68.0岁)和既往系统性治疗线数(3.0线、4.5线、4.0线)差异均有统计学意义。LBCL患者中18.8%为高级别B细胞淋巴瘤(HGBCL), 16.8%为转化型滤泡性淋巴瘤(TFL);DLBCL、HGBCL和TFL患者之间的生存结局无差异。
CD19 CAR-T绝对扩增以CD8为主,数量级在7个以上
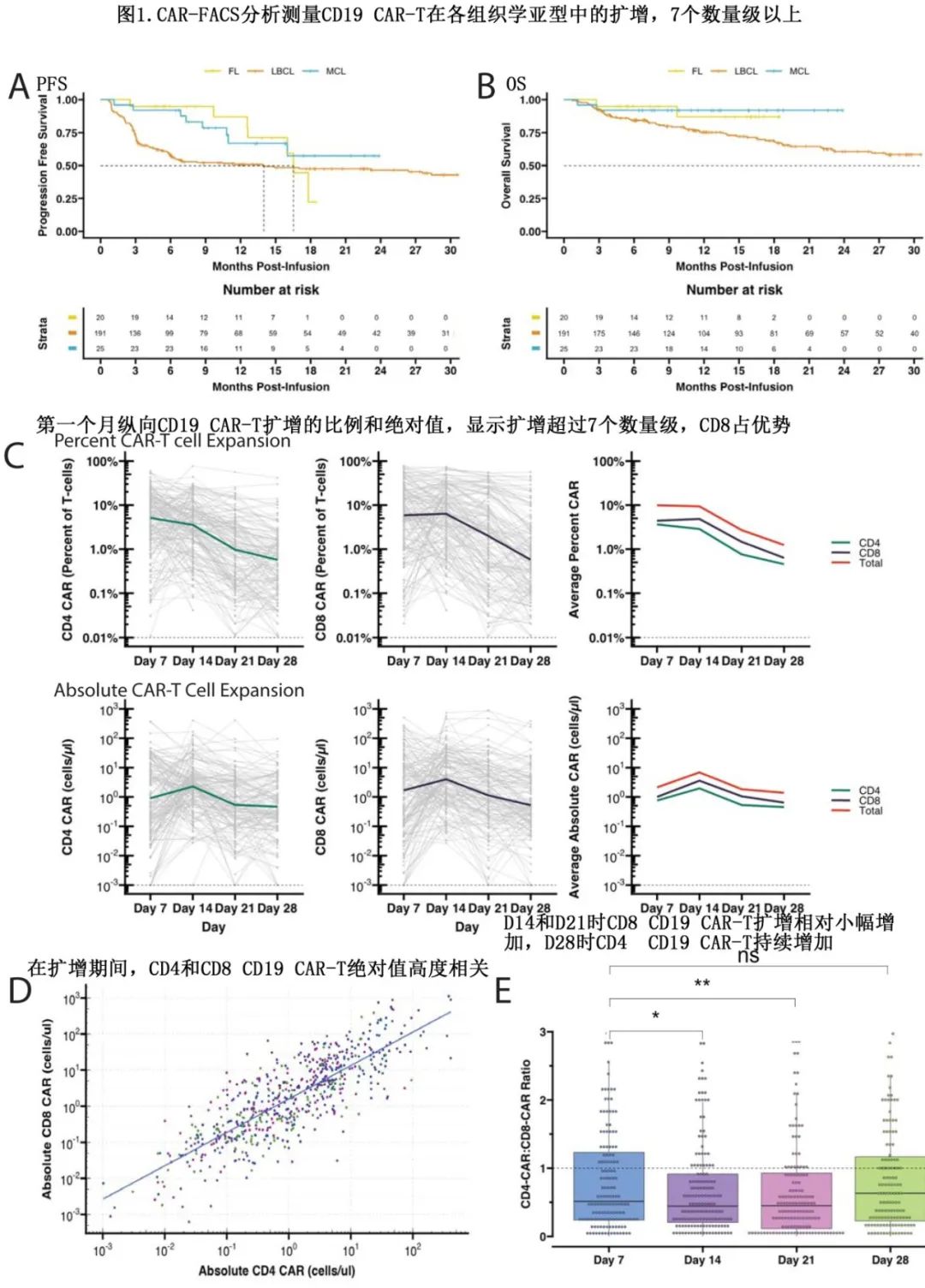
为了解CD19 CAR-T在NHL各亚型中的扩增及如何影响临床结局,前瞻性地在D7、D14、D21和D28日采集患者血液,通过实时外周血免疫表型分型(CAR-FACS)监测CD19 CAR-T扩增情况,共收集到188例患者的639份样本。此外,在35例个体患者中通过对115次axi-cel qPCR测定结果验证流式细胞术的效用,结果高度相关(Pearson系数=0.52,p<1E-8)。
CD19 CAR-T免疫表型分析可定量CD4+和CD8+ CD19 CAR-T水平,用于纵向和 AUC 分析。D7时 CAR 的中位比例为 T 细胞的14.67%(图1C),但D28降至中位数1.33%,表明在前28天内CD19 CAR-T作为 T 细胞群的比例迅速丢失。CD19 CAR-T总绝对计数范围为7个数量级以上(图1C),在 D14 达到CD19 CAR-T扩增峰值。CD4+ 和CD8+ CD19 CAR-T的绝对值高度相关(Spearman Rho 0.81,p<1E-15;图1D),表明每个人群的扩展相当。在整个研究期间,整体CD8+ CD19 CAR-T占优势(图1E),各时间点的中位CD4:CD8比值为0.62。与 D7 相比,D14和 D21 时CD4+:CD8+ 降低,但在 D28 时无显著差异(分别为p<0.05、p<0.005;图1E)。这些结果表明初始CD8+ CD19 CAR-T占优势及CD4+细胞持久性更高。
MCL组织学的CD19 CAR-T扩增较高
为了解治疗前变量如何纵向影响CD19 CAR-T扩增,使用多因素线性混合效应模型来确定CD19 CAR-扩增的每天变化。与 axi-cel 治疗 LBCL 或 FL 相比,brexu-cel治疗 MCL 的CD19 CAR-T 扩增最高,MCL 在D14、D21和 D28 的CD19 CAR-T水平显著更高(p<0.05、p<0.01、p<0.05;图2A)。D14、D21和D28时LBCL vs MCL 的中位CD19 CAR-T计数如下:6.24 vs 21.7、1.69 vs 6.87和1.01 vs 6.88个细胞/μl。LBCL的 AUC 显著低于MCL(p<0.005;图2B),中位 AUC分别为159.76和649.39(差异为4.06倍,天x细胞/μl)。
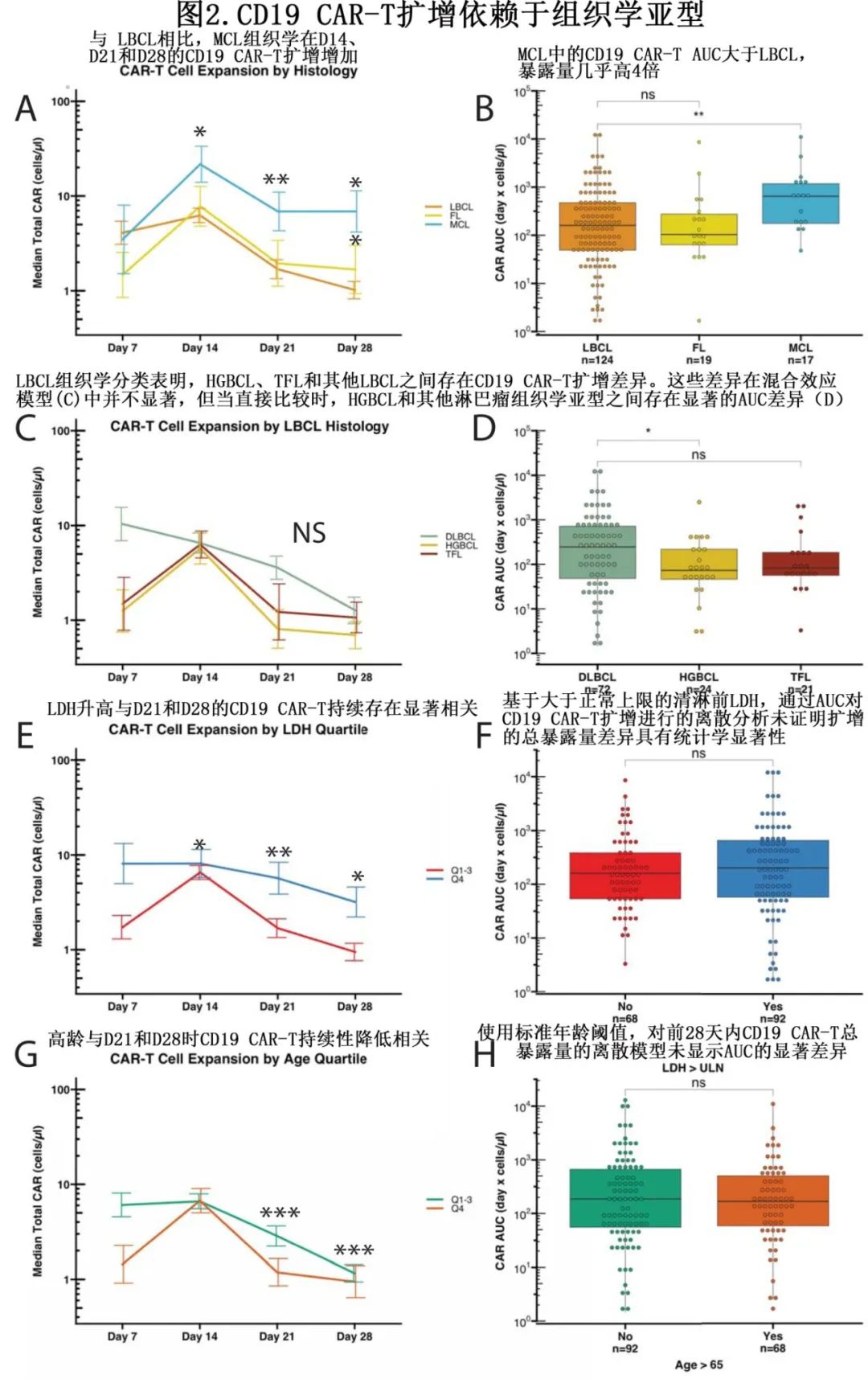
LBCL(DLBCL、HGBCL和TFL)中也发现CD19 CAR-T的差异。利用多因素混合效应模型和向后逐步回归分析,不同组织学的每天CD19 CAR-T扩增水平无显著差异(图2C)。步骤消除前,HGBCL和 DLBCL 之间存在主要效应差异 (p=0.05)。HGBCL 与 DLBCL 存在显著差异,HGBCL组织学的CD19 CAR-T绝对扩增显著低于 DLBCL 组织学 (p<0.05,图2 D)。
清淋前较高LDH与D7、D14和D21的CD19 CAR-T持久性增加相关(p<0.05, p<0.005和p<0.05)。对差异进行的探索性分析表明,持久性增加主要是由LDH的最高四分位数驱动(图2E)。但在高于或低于正常值上限(ULN)的患者中AUC无差异(图2F)。在混合效应模型中,年龄较大的患者在D21和D28上的CD19 CAR-T持久性降低,该混合效应模型同样由年龄的最高四分位区间驱动(p<0.0005,p=0.0005;图2B)。同样,使用标准阈值时,老年患者和年轻患者之间的AUC无差异(图2H)。
LDH 和年龄变量的差异的效应量显著小于 MCL 组织学的组织学差异,这些变量在可评价患者中也无 AUC 差异,表明 CD19 CAR-T 总暴露量无重大差异。因此可将 MCL 组织学解释为该数据集中CD19 CAR-T扩增的主要治疗前驱动因素。总之,CAR-FACS 数据显示 CD19 CAR-T 扩增具有疾病组织学依赖性;具体而言,在接受 brexu-cel 治疗 MCL 的患者中,CD19 CAR-T扩增和持续性较高。
为更好地理解为什么MCL的CD19 CAR-T 扩增较多,分析了cBioPortal上公开的微阵列数据集,该数据集包括95例DLBCL、65例FL和43例MCL标本。结果MCL中CD19的表达水平显著高于DLCBL,数据集内中位原始Affymetrix计数:MCL= 654.59, DLBCL= 294.66, FL= 377.02。虽然这些数据本身不确定,但可表明MCL可能有更高的CD19表面抗原密度来驱动扩增。
MCL患者的毒性更大
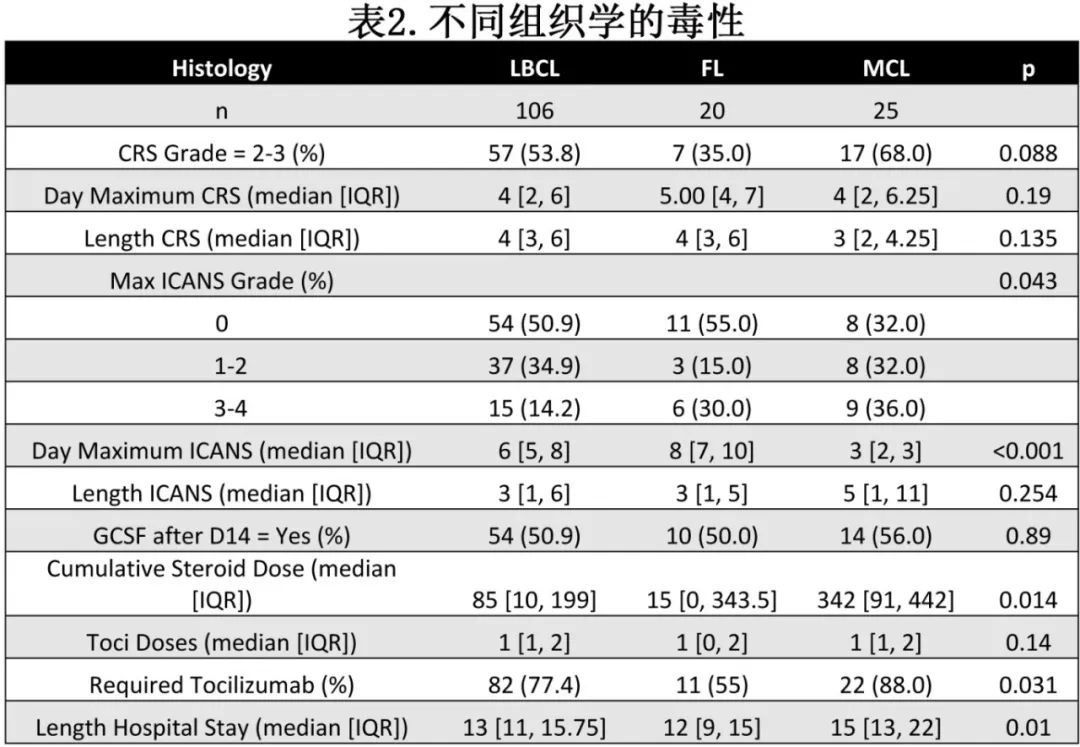
据报道CD19 CAR-T扩增与毒性相关,因此MCL患者将比LBCL患者经历更大的毒性,因此比较了接受治疗的LCBL、MCL和FL患者,以确定毒性的差异。
与CD19 CAR-T暴露较高相一致,MCL患者的高级别ICANS发生率也显著高于LBCL患者(3-4级ICANS:36% vs 14.2%,p<0.05,表2),此外MCL患者输注后类固醇暴露的中位累积剂量(地塞米松mg)是LBCL的4.02倍(LBCL 85mg vs MCL 342mg, p<0.05),88%的MCL患者需要托珠单抗,而LBCL患者为77.4%。MCL患者中位住院时间为15天, LCBL患者为13天, FL患者为12天 (p<0.05)。两组CRS发生率无差异。综上所述,与LBCL和FL患者相比,MCL患者ICANS严重程度高,激素和托珠单抗暴露更多,住院时间更长。
在治疗的第一个月,CD19 CAR-T扩增与所有主要CAR-T毒性均相关
比较CD19 CAR-T的AUC与CD19 CAR-T相关毒性(包括CRS分级、ICANS分级和第14天后的G-CSF依赖);G-CSF用于ANC<1000的患者,可作为长期中性粒细胞减少的替代指标。CD19 CAR-T的AUC与CRS严重程度增加、ICANS严重程度增加和D14后GCSF依赖显著相关(p<0.0001、p<0.001、p<0.01;图3A-D)。
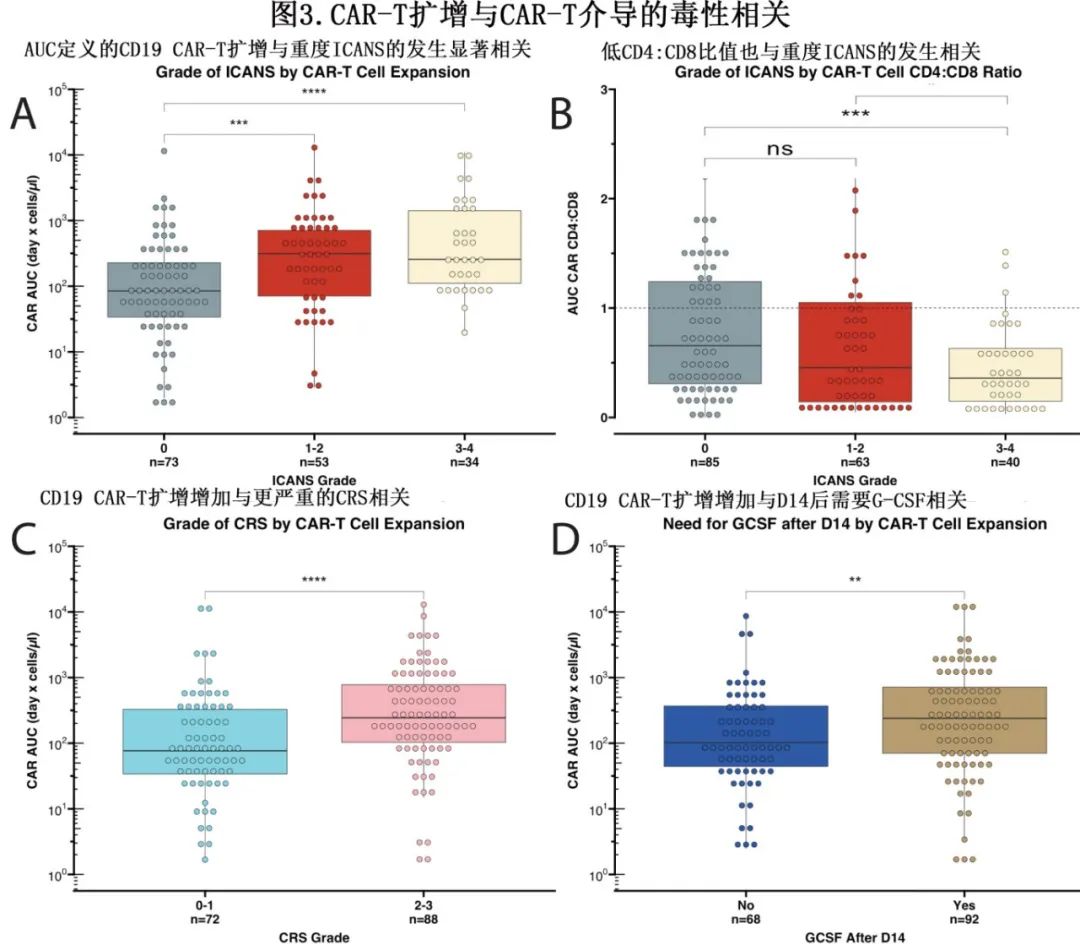
还测量了CD4+:CD8+比值,以确定其与CD19 CAR-T相关毒性的关联。重度(3-4级)ICANS患者的CD4+:CD8+比值显著低于轻度(1-2级)ICANS患者或无ICANS患者(比较无ICANS患者和有3-4级ICANS患者的CD4+:CD8+ CD19 CAR-T比值,p<0.001;图3B)。此外在D14后,与CRS或G-CSF相关的CD4+:CD8+比值无差异。
MCL患者的CD19 CAR-T扩增最大,相应的毒性也高(图2A)。为了解CD19 CAR-T扩增与组织学相比的相对贡献,进行了多因素有序回归分析,还检测了D7 CD19 CAR-T扩增(log10细胞/μl)及D7 CD4+:CD8+ CD19 CAR-T比值。通过逐步向后回归消除变量后,只有D7 CAR扩增和患者年龄与ICANS增加相关(CD7扩增为p<0.0005,年龄为p<0.05)。此外,即使将D7前发生ICANS的所有患者从该模型中剔除并进行相同的分析,CD19 CAR-T扩增增加仍与ICANS的发生显著相关(p<0.01)。可以得出结论,CD19 CAR-T扩增是与ICANS相关性最强的变量。
通过外周血免疫表型测定的CD19 CAR-T扩增与生存结局改善无关
在LBCL队列中,使用单因素Cox比例风险模型确定CD19 CAR-T扩增与无进展生存期(PFS)之间的关联,结果CD19 CAR-T AUC与PFS无相关性。在27个选择的变量中,在单因素分析中与较差的生存结局相关的显著变量包括输注前高LDH (p<5E-6)、需要桥接治疗(p=0.039)、清淋前高CRP (p<0.001)和难治性疾病(p=0.049)。没有协变量与PFS结局改善相关,单独使用单因素D7 CAR扩增(n=134)也与PFS无显著相关性(p=0.32)。
CD19 CAR-T AUC和CD19 CAR-T峰值扩展均与最佳缓解(CR vs . PR+SD+PD)无关。同样,在发生进展和未发生进展的患者中,CD19 CAR-T AUC或CD19 CAR-T峰值扩增无差异。
作者假设CD19 CAR-T扩增可能与治疗前风险相互作用,从而确定较高或较低风险人群。在多项研究中,清淋前LDH是与结局相关的最一致的变量。在该队列的部分患者中,清淋前的LDH也与输注前的ctDNA强相关(LDH和输注前ctDNA之间的Spearman秩相关系数=0.65,p<1E-14,图4A)。因此,相对于单因素Cox分析中使用的变量,使用lasso回归检验了CD19 CAR-T扩增与清淋前LDH之间的交互作用。使用清淋前LDH的中位数(中位数=1.1xULN)和CD19 CAR-T的AUC中位数将数据集平分,以产生4个交互作用项(CARlow/LDHlow,CARlow/LDHhigh,CARhigh/LDHlow,CARhigh/LDHhigh)。然后使用选择性推断生成与每个选定的lasso变量相关的p值(图4B)。
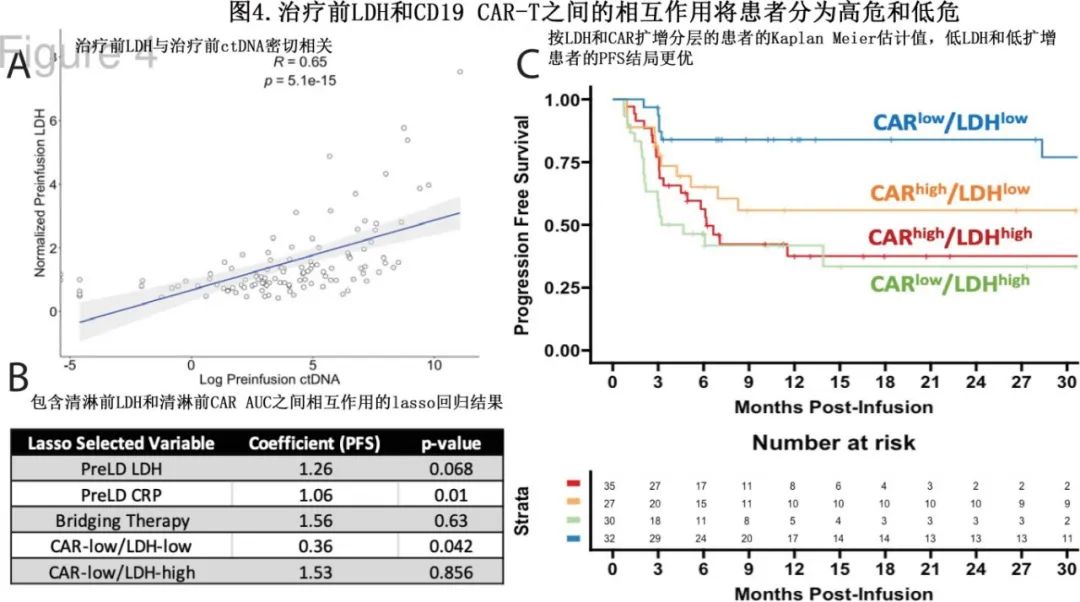
在lasso中,清淋前的LDH和CRP被选为导致较差的PFS结局的因素(分别为p=0.068和p=0.011,α显著性<0.1)。CARlow/LDHhigh人群和需要桥接治疗被lasso选择为PFS结局较差,但不显著(p=0.86和p=0.63)。前一项发现提示,在高肿瘤负荷的患者中,增加CAR扩增对于建立疾病控制是必要的。有趣的是,CARlow/LDHlow也有助于更好的PFS结局(HR=0.36, p=0.042;图4C)。CAR/LDH风险分层结果以Kaplan -Meier图表示,见图4C。
该结果颇为出乎意料,因为它表明,在低LDH的患者中,低CD19 CAR-T扩增患者预后显著优于其他患者组。作者进一步比较了CARlow/LDHlow组患者和CARhigh/LDHlow组患者(表3),两组较为平衡但CARlow/LDHlow组在单采时具有分期较低的趋势;在可评估患者中,清淋前LDH或输注前ctDNA均无差异。CARhigh/LDHlow组患者的重度CRS和ICANS发生率显著较高,累积类固醇剂量也相应增加(表3),名义上的非复发死亡率也较高(4 vs 0)但不显著。在直接比较时,Cox模型显示CARhigh/LDHlow组的PFS较CARlow/LDHlow组差。
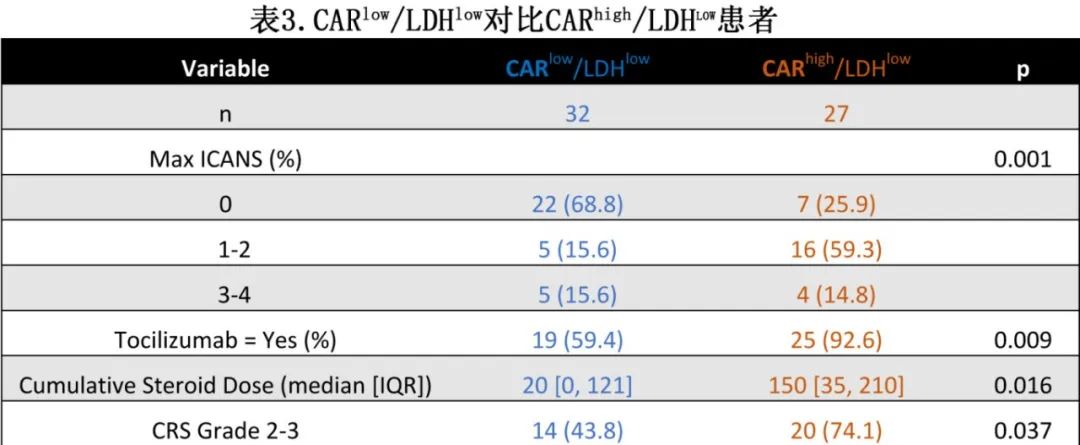
总体而言,血液CD19 CAR-T扩增与毒性相关,但不能预测PFS。而在根据LDH风险分层为较低危组的患者中,低CD19 CAR-T扩增与结局改善相关,部分原因可能是较低的毒性。
总结
为确定CD19 CAR-T扩增对患者结局的影响,作者在5年期间对接受CD19 CAR-T 治疗的236例MCL、FL和LBCL的患者队列进行前瞻性随访,并利用其中188例患者的外周血免疫表型分型获得CD19 CAR-T扩增数据。与其他淋巴瘤组织学亚型相比,MCL患者的CD19 CAR-T扩增率更高;但MCL患者的毒性也增加,需要的类固醇累积剂量是LBCL患者的4倍。CD19 CAR-T扩增与CRS、ICANS的发生以及输注后第14天G-CSF需求有关。年轻患者和LDH升高患者的CD19 CAR-T扩增显著较高。总体而言,未观察到CD19 CAR-T扩增与LBCL治疗反应之间存在关联,但在针对肿瘤负荷进行校正后发现,低CD19 CAR-T扩增联合低LDH与LBCL结局改善相关。总之,CD19 CAR-T扩增与CAR相关毒性相关。此外,在LBCL患者中,通过外周血免疫表型分型检测到的CD19 CAR-T扩增可能对获得良好结局不重要。淋巴瘤组织学驱动了扩增的差异,导致毒性的组织学特异性差异。
参考文献
Hamilton MP,et al.CAR19 monitoring by peripheral blood immunophenotyping reveals histology-specific expansion and toxicity.Blood Adv . 2024 Mar 18:bloodadvances.2024012637. doi: 10.1182/bloodadvances.2024012637.
TCT:CAR-T治疗老年NHL和MM的临床结局和毒性
![]() 0
2024-03-05
点击查看
0
2024-03-05
点击查看
BMT:欧洲2022年移植和细胞治疗的规模:CAR-T稳步增长,移植增长放缓
![]() 0
2024-03-07
点击查看
0
2024-03-07
点击查看

首批患者病情好转且停药!CAR-T疗法或有望“治愈”多种免疫疾病
![]() 0
2024-03-11
点击查看
0
2024-03-11
点击查看
疾病控制率达73%!《自然》子刊:CAR-T疗法有望“攻克”实体瘤,关键在这两大策略!
![]() 0
2024-03-12
点击查看
0
2024-03-12
点击查看

【BCJ】CAR-T细胞输注前减少和控制代谢活性肿瘤体积可改善LBCL生存结局
![]() 0
2024-03-15
点击查看
0
2024-03-15
点击查看

EBMT摘要: RRMM中不同BCMA CAR-T的有效性间接比较
![]() 0
2024-03-17
点击查看
0
2024-03-17
点击查看
