最新的全球健康组织的数据显示,心血管疾病在全球范围内的发病率和死亡率持续上升。每年心血管疾病导致超过1700万人死亡,成为全球最大的死亡原因之一。心肌纤维化是包括心房颤动、冠状动脉疾病、心肌梗死、糖尿病心肌病在内的多种心脏病的共同病理特征。这一过程可能导致心脏壁的异常增厚和结构重塑,从而影响心脏的正常功能。有效的预防和治疗措施可以减缓或逆转这一过程,从而改善患者的心脏功能,提高生活质量。因此,加强对心肌纤维化的研究和临床关注,对心血管健康至关重要。
Piezo机械门控离子通道(Piezo mechano-gated ion channel)是在内皮细胞和血管平滑肌细胞中表达的机械门控离子通道。这些通道被剪应力激活,与局部血流增加和血压升高时细胞膜拉伸有关。研究发现,机械门控离子通道在心血管发育、生理和疾病中起着关键作用。尽管关于机械门控离子通道的学术文献不断增多,但有关表观调控的机械门控离子通道研究却相对匮乏。尤其是,对于心肌纤维化过程中关于机械门控离子通道的作用机制知之甚少。
2024年11月5日,安徽医科大学第二附属医院陶辉教授团队与上海交通大学医学院附属新华医院赵健元教授团队合作在欧洲心脏病学会的知名期刊Cardiovascular Research 杂志在线发表了题为“Epitranscriptomic regulation of cardiac fibrosis via YTHDF1-dependent PIEZO2 mRNA m6A modiffcation”的论文。该论文采用心肌纤维化的小鼠模型及细胞实验证明了一种新的表观转录组学调控机械门控离子通道机制,即YTHDF1通过识别Piezo2并通过m6A依赖性调节控制心肌成纤维细胞自噬和纤维化,为心肌纤维化预防措施的发展提供了新的见解。

首先,研究者通过转录组测序数据观察到,Piezo2的表达随着心肌纤维化标志物CoL1A1和POSTN的表达增加而显著增加。组织免疫荧光实验显示了Piezo2与POSTN在小鼠模型组织中的共表达谱。反复验证后,研究者表明在实验性心肌纤维化模型中,Piezo2表达升高。
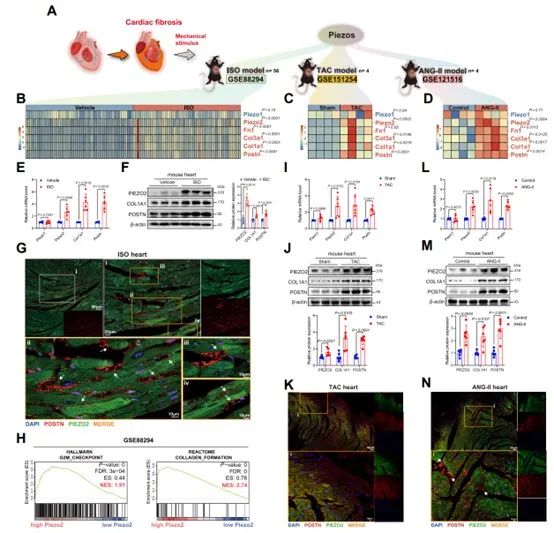
随后,研究者分析了单细胞RNA测序数据和数据集研究了Piezo家族成员在单细胞水平上的表达,发现在TAC和Ang II模型中,Piezo2在心肌成纤维细胞中显著富集。研究者将成纤维细胞分为15个亚簇,并通过细胞伪时间分析发现Piezo2在活化的心肌成纤维细胞中特异性富集。接着,研究者使用荧光原位杂交(FISH)和Western blotting验证了Piezo2表达的显著增加。这些结果表明,在心肌成纤维细胞中,Piezo2表达特异性增加。
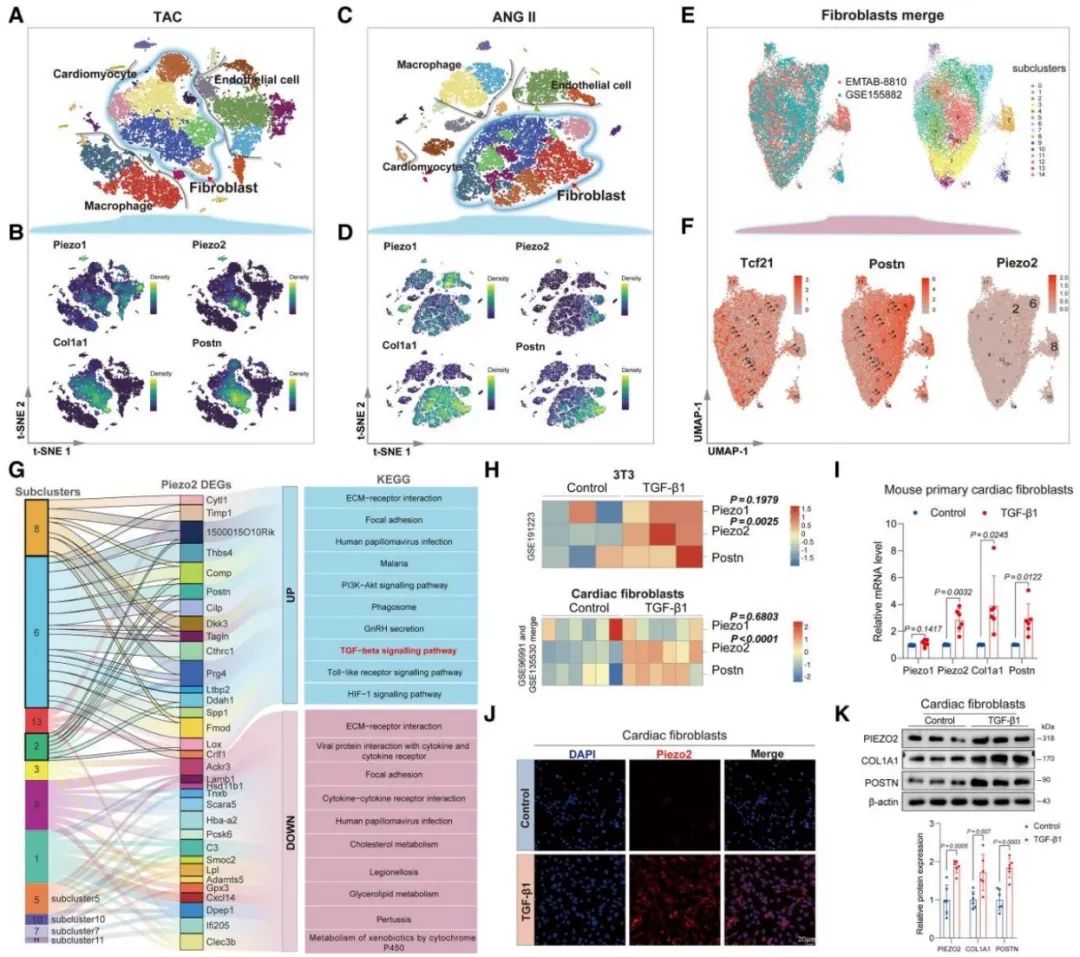
随后为了进一步探讨Piezo2对心肌成纤维细胞活化的作用,研究者进行了Piezo2敲除实验,验证了Piezo2缺乏通过降低细胞自噬水平抑制心肌成纤维细胞激活和纤维化。
接下来,研究者探究了Piezo2在实验性心肌纤维化模型和原代培养的心肌成纤维细胞中的作用机制。研究者通过分析确定了Piezo2受m6A甲基化调节,随后的MeRIP-Seq显示在Piezo2的编码序列(CDS)和3'UTR区域中有大量的m6A修饰,整合基因组观察器显示了m6A修饰的峰值Piezo2的分布。这些结果表明,Piezo2受到N6腺嘌呤甲基化修饰。
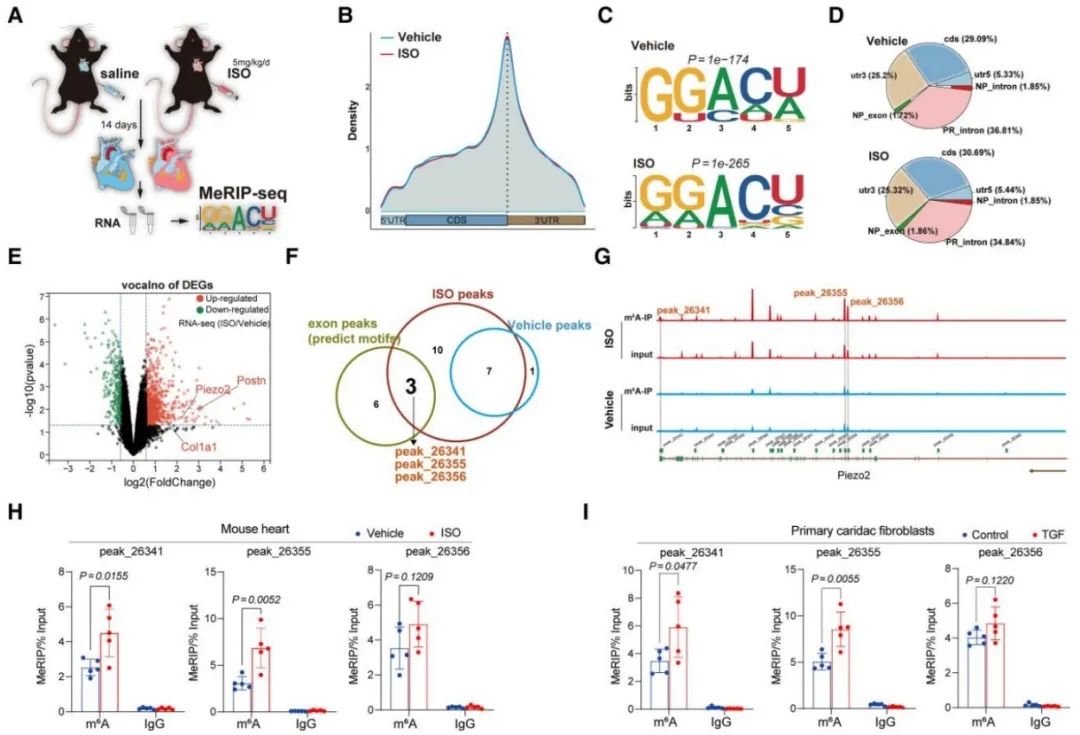
最后,研究者发现并证明了Piezo2以依赖于YTHDF1的方式通过m6A修饰进行调节,并进一步使用AAV9-YTHDF1/ISO小鼠模型证明了这一发现。
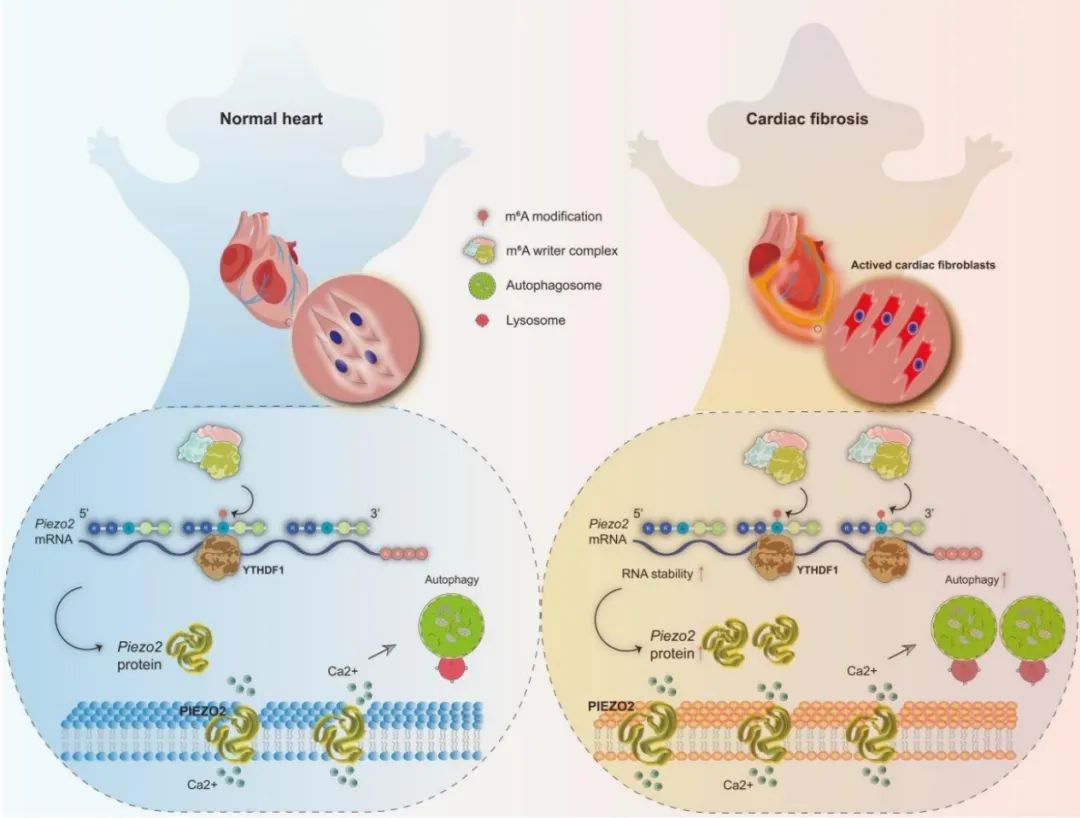
综上所述,该研究发现了Piezo2在实验性心肌纤维化中表达增加,并伴随着在心肌成纤维细胞的显著富集。Piezo2的表观转录组学抑制改善了实验性心肌纤维化,Piezo2引起细胞内Ca2+水平的增加、心肌成纤维细胞增殖、自噬和心肌纤维化。此外,研究者引入了一种新的表观转录组学机制,即YTHDF1作为Piezo2表达的关键调节器,它通过促进心肌成纤维细胞自噬进而缓解心肌纤维化。这一研究阐明了Piezo2在心肌成纤维细胞活化和纤维化过程中的作用机制。
丁季飞博士(现为美国贝勒医学院博士后)、博士生涂彬、博士生宋凯、硕士生刘震宇为本文共同第一作者;安徽医科大学第二附属医院陶辉教授、上海交通大学医学院附属新华医院赵健元教授为共同通讯作者。
参考文献:
1. Ding JF, Tu B, Song K, Liu ZY, Lin LC, Liu ZY, Shi Y, Yang JJ, Zhao JY, Tao H. Epitranscriptomic regulation of cardiac fibrosis via YTHDF1-dependent PIEZO2 mRNA m6A modification. Cardiovasc Res. 2024:cvae239.
2. Lin LC, Liu ZY, Yang JJ, Zhao JY, Tao H. m6A epitranscriptomic modification in diabetic microvascular complications. Trends Pharmacol Sci. 2023 Oct 26:S0165-6147(23)00215-8.
3. Liu ZY, Lin LC, Liu ZY, Song K, Tu B, Sun H, Zhou Y, Mao S, Zhang Y, Li R, Yang JJ, Zhao JY, Tao H. N6-Methyladenosine-mediated phase separation suppresses NOTCH1 expression and promotes mitochondrial fission in diabetic cardiac fibrosis. Cardiovasc Diabetol. 2024 Sep 28;23(1):347.
4. Wang J, Zhao R, Xu S, Zhou XY, Cai K, Chen YL, Zhou ZY, Sun X, Shi Y, Wang F, Gui YH, Tao H, Zhao JY. NOTCH1 mitochondria localization during heart development promotes mitochondrial metabolism and the endothelial-to-mesenchymal transition in mice. Nat Commun. 2024 Nov 16;15(1):9945.
5. Zou Z, Wei J, Chen Y, Kang Y, Shi H, Yang F, Shi Z, Chen S, Zhou Y, Sepich-Poore C, Zhuang X, Zhou X, Jiang H, Wen Z, Jin P, Luo C, He C. FMRP phosphorylation modulates neuronal translation through YTHDF1. Mol Cell. 2023 Dec 7;83(23):4304-4317.e8.
原文链接:
https://doi.org/10.1093/cvr/cvae239
J Ethnopharmacol:丹参有效成分通过AKT/GSK3β信号通路抑制心肌成纤维细胞的增殖和分化
![]() 0
2024-07-05
点击查看
0
2024-07-05
点击查看

Nat Commun 湖北大学张冬卉/上海儿童医学中心张浩团队合作开发人心脏类器官损伤-修复新模型定量解密心肌纤维化
![]() 0
2024-09-14
点击查看
0
2024-09-14
点击查看

Nat Commun 哈尔滨医科大学杨宝峰院士团队揭示抑制促凋亡基因ASPP1减轻心肌梗死导致的心肌纤维化
![]() 0
2024-10-10
点击查看
0
2024-10-10
点击查看

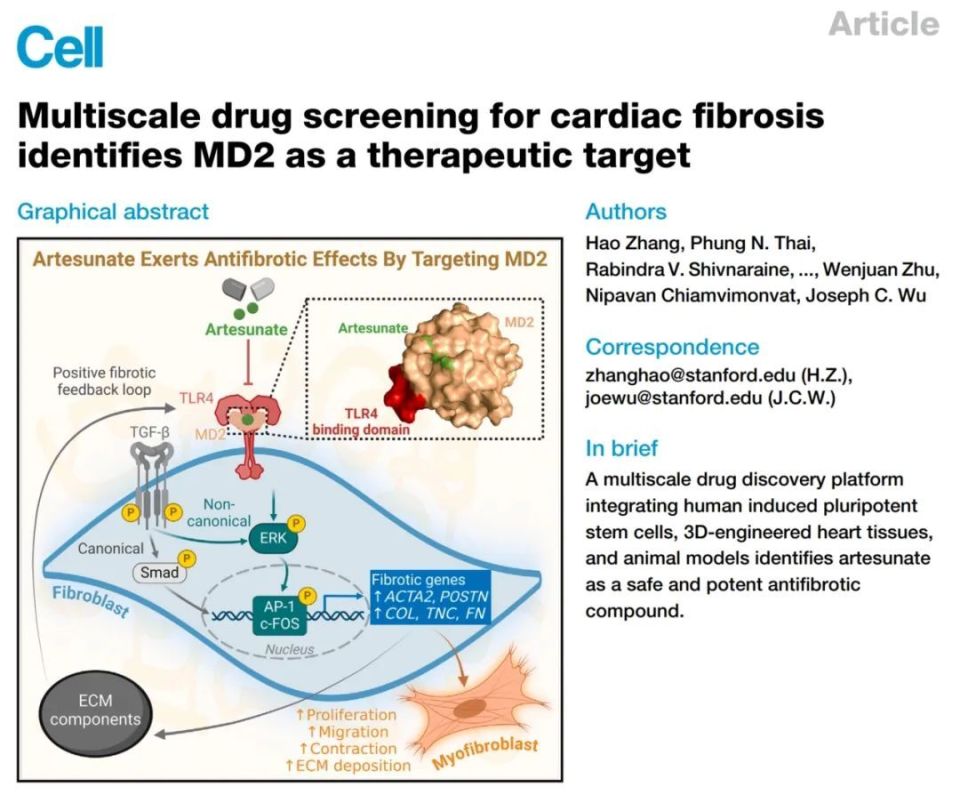
Cell:抗疟疾药物青蒿琥酯或能治疗心肌纤维化
![]() 0
2024-10-17
点击查看
0
2024-10-17
点击查看
JAHA:冠状动脉微血管稀疏和心肌纤维化与冠状动脉疾病的关系
![]() 0
2024-10-20
点击查看
0
2024-10-20
点击查看

Phytomedicine:补肾活血益气方通过SIRT1/Notch1通路介导的EndMT减轻缺血性心力衰竭心肌纤维化
![]() 0
2024-11-26
点击查看
0
2024-11-26
点击查看
