新一代抗体药物偶联物(ADC),常被比作“魔法子弹”。从现有上市产品来看,把它称为“靶向化疗”或许更为形象。它相当于给传统化疗药安上了瞄准镜,实现对肿瘤的精准靶向打击。现阶段ADC主要围绕HER-2,BCMA,EGFR,CD家族等相对成熟的靶点进行开发。到目前为止,全球共上市的14款ADC,7款用于治疗实体瘤,涉及到的靶点有HER-2,TROP-2等等。相比胃癌、尿路上皮癌、非小细胞肺癌,在乳腺癌相关领域更加出彩!
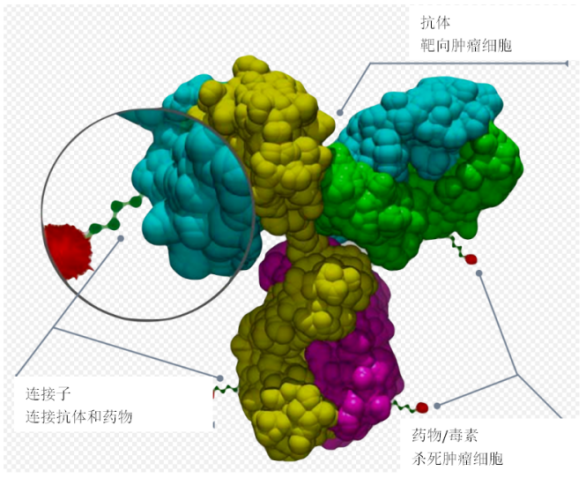
HER2强悍保底
人表皮生长因子受体 2(HER2)阳性乳腺癌约占全部乳腺癌的 20%~25%,在过去的20年中,HER2+乳腺癌的治疗发生了巨大变化,HER2单抗、小分子抑制剂等大大改善了HER2阳性乳癌患者的治疗现状,但HER2阳性的乳腺癌的临床实践尚有巨大的治疗需求未得到满足,患者面临着复发和耐药等多重问题。近年来,ADC类药物迅速崛起并在临床上广泛应用。
1
FDA接受申请,欧盟验证!
HER2乳腺癌治疗又上新台阶
近日,FDA就接受了 vic-trastuzumab duocarmazine (SYD985) 的生物制剂许可申请 (BLA),用于治疗 HER2 阳性不可切除的局部晚期或转移性乳腺癌患者。

不仅如此,2022 年 7 月 18 日,欧洲药品管理局 (EMA) 还验证 vic-trastuzumab duocarmazine (SYD985) 的上市许可申请 (MAA),用于治疗 HER2 阳性不可切除、局部晚期或转移性乳腺癌患者。
两项申请进展均是基于关键 3 期 TULIP 试验的结果,这是一项多中心、开放标签、随机试验,纳入的患者在转移性环境中接受过至少 2 种先前治疗。其中曲妥珠单抗( duocarmazine )患者以 2:1 的比例随机分配至 1.2 mg/kg 的静脉曲妥珠单抗 (n = 291),每 21 天一次,或传统治疗方案 (n = 146),直至疾病进展或出现不可接受的毒性。传统治疗包括拉帕替尼(Tykerb)加卡培他滨(希罗达)、曲妥珠单抗(赫赛汀)加卡培他滨、曲妥珠单抗加长春瑞滨或曲妥珠单抗加艾日布林。
该研究的主要终点是集中评估的 PFS。
次要终点包括研究者评估的 PFS、总生存期 (OS)、总缓解率 (ORR) 和健康相关生活质量 (HRQoL)。
与传统治疗方案相比,在该患者群体中显著提高了无进展生存期 (PFS),达到了主要终点。根据研究结果显示,曲妥珠单抗组的中位 PFS 为 7.0 个月(95% CI,5.4-7.2)与 4.9 个月(95% CI,4.0-5.5)(HR,0.64;95% CI,0.49- 0.84;P = .002);PFS 分别为 6.9 个月(95% CI,6.0-7.2)和 4.6 个月(4.0-5.6)(HR,0.60;95% CI,0.47-0.77;P <0 .001)。
该研究在 2021 年 ESMO 大会上公布的其他结果显示,使用曲妥珠单抗 duocarmazine 的中位 OS 为 20.4 个月(95% CI,18.0-23.7),而医生选择的中位 OS 为 16.3 个月(95% CI,13.4-22.8)治疗(HR,0.83;95% CI,0.62-1.09; P = 0.153)。曲妥珠单抗的 ORR 为 27.8%,而医生选择的 ORR 为 29.5%,临床受益率分别为 38.5% 和 32.2%。
安全性方面,大约一半的患者经历了 3 级或更高级别的治疗相关不良反应 (TRAE)。曲妥珠单抗最常见的 3 级或更高级别 TRAE 是角膜炎 (12.2%)、结膜炎 (5.6%) 和中性粒细胞减少症 (4.9%)。医生选择的最常见的 3 级或更高级别 TRAE 包括中性粒细胞减少症(18.2%)、掌跖感觉迟钝综合征(3.6%)和腹泻(2.2%)。
2
T-DM1,开启HER2新篇章
2013年,FDA批准Trastuzumab Emtansine Kadcyla(T-DM1,赫赛莱)上市,用于治疗HER2阳性的转移性乳腺癌患者,成为全球首个获批的单药治疗实体瘤的抗体药物偶联物。2020年1月,国家药品监督管理总局正式批准创新靶向药物赫赛上市。这是中国上市的第一个HER2靶向与化疗偶联的ADC产品。
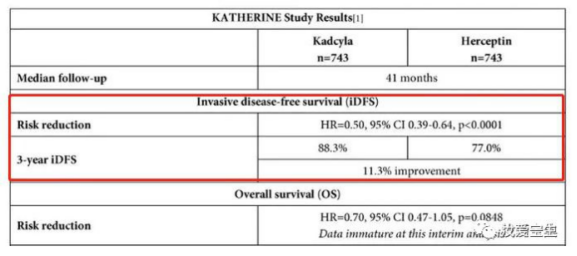
让T-DM1一炮而红的著名的KATHERINE研究是一项国际多中心Ⅲ期临床研究,共计纳入1486例采用含曲妥珠单抗方案进行新辅助治疗后non-pCR的HER2阳性乳腺癌患者,这部分患者有多数单独应用曲妥珠单抗,少部分患者应用曲妥珠单抗+帕妥珠单抗。入组患者1:1随机入组,分别接受T-DM1或曲妥珠单抗治疗。研究的主要终点是iDFS。全球ITT人群中,两组3年iDFS分别为88.3%和77.0%,绝对差异为11.3%,T-DM1组疾病复发、死亡风险较曲妥珠单抗组降低50%(HR 0.50;95%CI 0.39 ~ 0.64;P < 0.001 )。
3
ASCO指南更新,T-DXd为标准治疗选择!
“老熟人”HER2-ADC DS-8201(trastuzumab deruxtecan,T-DXd)在不久前闭幕的2022年美国临床肿瘤学会(ASCO)上展示了骄人战绩。
2022年6月21日,NCCN V4版乳腺癌指南将T-DXd正式作为HER2低表达人群的治疗推荐(1类证据);就在最近ASCO官网还发布HER2阴性乳腺癌指南更新说明:HER2 IHC 1+ 或 2+ 和 ISH 阴性的转移性乳腺癌患者,既往至少接受过一次转移性疾病化疗,如果 HR+ 对内分泌治疗无效,则应给予曲妥珠单抗 deruxtecan 治疗。这一快速推荐为使用曲妥珠单抗 deruxtecan 提供了及时的指导!

该指南全文将于近期发表于临床肿瘤学杂志(JCO),找药宝典将持续为您报道~
4
维迪西妥单抗最新ASCO数据
HER2型尿路上皮癌PFS达9.2个月!
RC48-C014是一项Ib/II期研究者发起的临床研究(IIT),用于评估RC48-ADC(DV)联合toripalimab在la/mUC中的安全性和疗效。
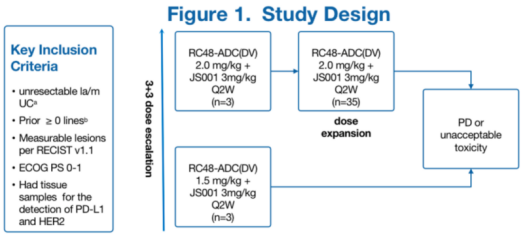
截至2022年4月22日,本研究的RP2D为 RC48-ADC 2mg/kg+JS001 3mg/kg,剂量递增期入组6例患者,剂量扩展期入组35例患者。截至2022年4月22日,39例至少有两次肿瘤评估的患者中,cORR为71.8% (95%CI: 55.1, 85),包括3例CR(7.7%),25例PR(64.1%); DCR为92.3% (95%CI: 79.1, 98.4)。一线cORR 为73.9%,六个亚组HER2 IHC(2 + /3 +) PD-L1 (+),HER2 IHC (2 + /3 +) PD-L1 (-), HER2 IHC (1+) PD-L1 (+),HER2 IHC (1+)PD-L1 (-),HER2 IHC (0) PD-L1 (+), HER2 IHC (0) PD-L1(-)的cORR分别为85.7%,86.7%,50%,60%,0%和50%。总体mPFS 为 9.2 个月,mOS未达到。
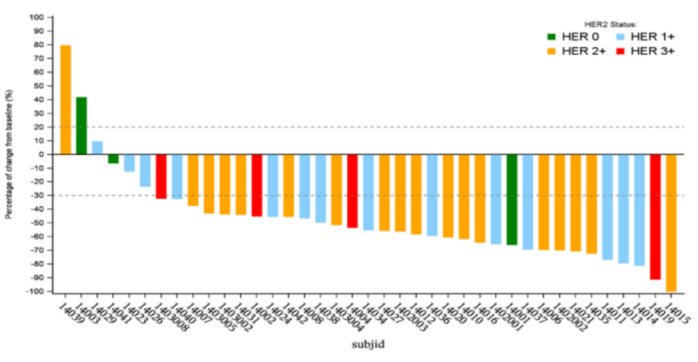
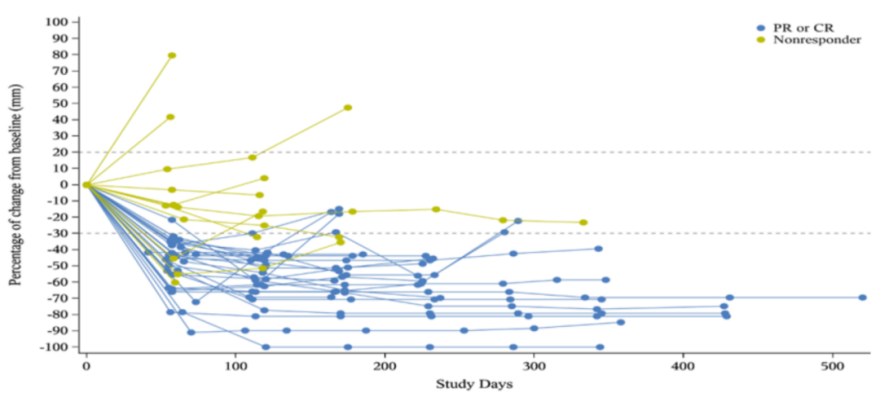
CDH6靶点新进展,DS-6000注入新鲜活力!
DS-6000是基于第一三共的DXd技术平台开发的ADC,其安全性有效数据为ADC发展注入新力量!
在20例可评估的患者中有6例取得PR,其中5例OVC患者,ORR为35.7%(现有末线疗法仅10%左右);1例RCC患者,ORR为16.7%。6例PR的患者中,3例患者剂量为9.6mg/kg,但该剂量下不良反应比较严重,患者的生存获益可能因此受到限制。
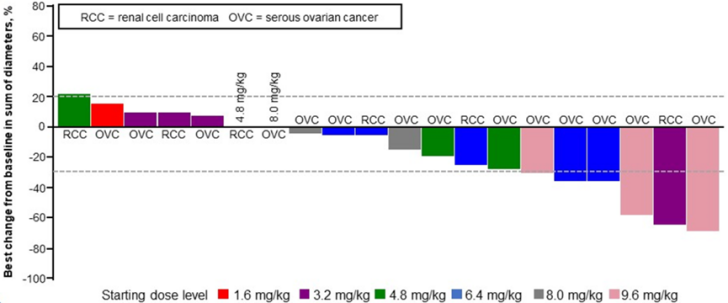
乳癌新靶点HER3诞生,ADC药物再展神威!
本次ASCO大会上公布了HER3-DXd I/II期研究 U31402-A-J101 的研究结果,旨在评估HER3-TDXd在HER3表达的转移性乳腺癌中的疗效和安全性。

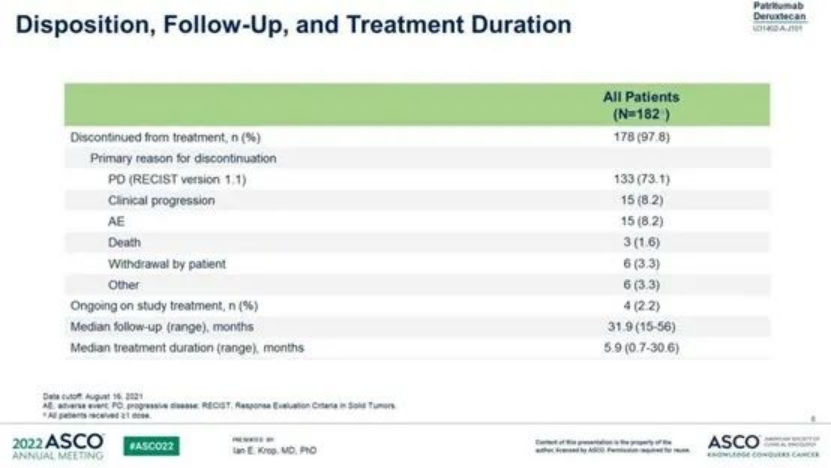
截至 2021 年 8 月 16 日,研究中位持续时间为 31.9 个月,HER3-DXd 中位治疗持续时间为 5.9 个月 (范围,0.7-30.6)。该研究纳入182例患者,其中包括HER3高表达和低表达的HR+/HER2-乳腺癌(n=113)、HER3高表达TNBC(n=53)和HER2+乳腺癌(n=14)。目前,多数患者已经终止治疗。研究中,患者终止治疗的首要原因主要是疾病进展(73.1%),因AE和死亡终止的患者比例分别为8.2%和1.6%。
有效性数据显示,HR+/HER2-、HER3高表达TNBC和HER2阳性乳腺癌患者的客观缓解率(ORR)分别为30.1%、22.6%和42.9%,疾病控制率(DCR)为7.2%、5.9%和8.3%,治疗响应程度全部为PR。三个亚组中,mDOR分别为7.2个月、5.9个月和8.3个月;mPFS为7.4个月、5.5个月和11.0个月;mOS为14.6个月、14.6个月和19.5个月。

安全性方面,130 名患者 (71.4%) 患者出现 ≥3 级 AE,最常见是骨髓抑制相关不良反应其中中性粒细胞计数减少(39.6%)、血小板计数减少(30.8%)、贫血(18.7%)和白细胞计数减少(18.1%),另外 12 名患者 (6.6%) 出现治疗相关的间质性肺炎。

研究表明,Patritumab deruxtecan 在多线治疗后、HER3表达的乳腺癌患者中显示出临床意义,在 HR+/HER2- 和 HER2+ MBC 以及 TNBC 各亚型中均显示出持久的抗肿瘤活性,且安全性可控,患者对治疗表现出足够耐受。HER3-dxd对不同类型转移性乳腺癌治疗的研究仍在进行中,研究者也将更关注于与其疗效相关的生物标志物。
SG将无进展生存期PFS延长1.5个月
TROPiCS-02研究的入组标准为HR+/HER2-不可切除的局部晚期或MBC,ECOG表现状态为0或1,经2-4线化疗的MBC的成年患者;如果患者在(新)辅助治疗后12个月内疾病进展,则该MBC患者经1线治疗也可入组。在任何情况下,入组患者必须至少接受过1种紫杉类药物、1种CDK4/6抑制剂和一种内分泌治疗。患者随机(1:1)入组,接受SG(10 mg/kg IV,第1和 8天,每21天一次)或TPC(卡培他滨、艾力布林、长春瑞滨或吉西他滨),直至出现疾病进展或无法耐受的毒性。根据实体瘤疗效评价标准(RECIST 1.1),主要研究终点为盲法独立评审委员会评估的PFS,关键次要研究终点为OS。

截至2022年1月3日,共纳入SG组272例和TPC组271例患者。两组患者特征相似(MBC的中位化疗线数为3[0-8];95%患者内脏转移,86%患者针对MBC的内分泌治疗时间≥6个月,针对MBC的CDK4/6抑制剂治疗时间≤12个月和> 12个月的比例分别为60%和38%)。
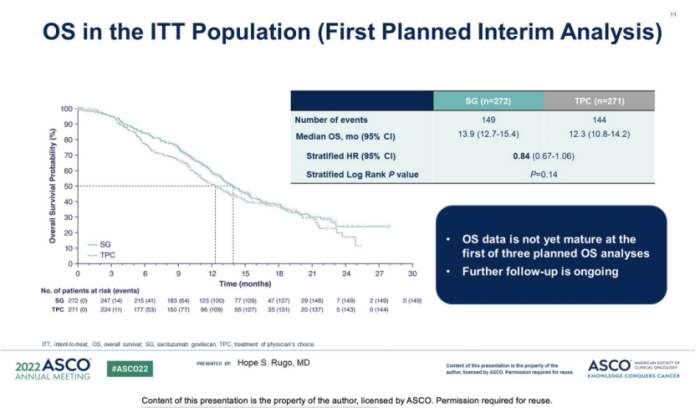
结果显示:SG可改善中位PFS (5.5 vs 4.0个月;HR,0.66;95%CI,0.53-0.83;P= 0.0003);6个月和12个月的PFS率分别为46% vs 30%和21% vs 7%。在OS方面,SG组显示了数值上差异但未显示统计学差异(13.9 vs 12.3个月;HR,0.84;P=0.143)。SG组的ORR(21% vs 14%)和临床获益率(34% vs 22%)高于TPC组,中位缓解持续时间分别为7.4个月vs 5.6个月。
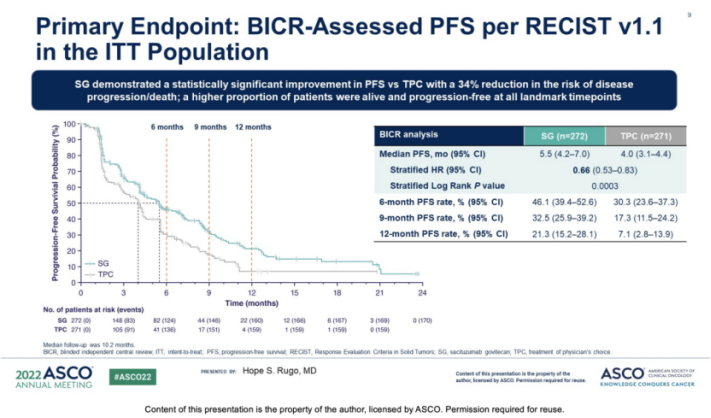
总体而言,74% vs 60%的患者(SG vs TPC)发生≥3级治疗紧急不良事件(AEs);中性粒细胞减少(51% vs 39%)和腹泻(10% vs 1%)最常见。导致SG停药的AEs比TPC低(6%比4%)。SG组有1例患者发生治疗相关死亡,TPC组没有。
与单药化疗相比,SG具有统计学上显著的,且有临床意义的PFS获益,但实际上在业内这个差异是微小的,低于行业预期,与化疗相比,SG仅将PFS仅延长了1.5个月。
参考资料:
https://www.onclive.com/view/fda-accepts-bla-for-trastuzumab-duocarmazine-for-advanced-her2-breast-cancer
声明:
本资料中涉及的信息仅供参考,请遵从医生或其他医疗卫生专业人士的意见或指导。
Lung Cancer:国人不吸烟小细胞肺癌患者特点
![]() 0
2018-02-12
点击查看
0
2018-02-12
点击查看
J Natl Cancer Inst:HR+/HER2-乳腺癌哌柏西利联合内分泌治疗的长期安全性分析
![]() 0
2018-07-20
点击查看
0
2018-07-20
点击查看

Gastroenterology: 二甲双胍与依维莫司和/或生长抑素类似物在胰腺内分泌肿瘤的治疗中无明显作用
![]() 0
2018-08-31
点击查看
0
2018-08-31
点击查看

长PFS、长OS、安全性佳、对脑转移疗效佳,奥希替尼或为EGFR突变阳性晚期NSCLC的一线治疗**
![]() 0
2019-12-02
点击查看
0
2019-12-02
点击查看
肿瘤中的中位PFS:不能过度迷信,这里也有陷阱
![]() 0
2020-03-16
点击查看
0
2020-03-16
点击查看
君实生物特瑞普利单抗一线治疗鼻咽癌III期临床研究PFS预估显著
![]() 0
2020-09-29
点击查看
0
2020-09-29
点击查看