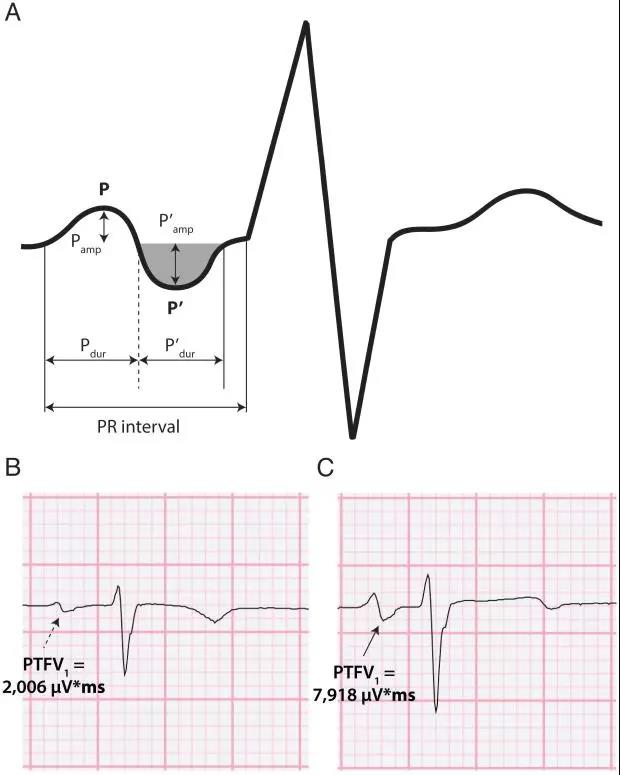

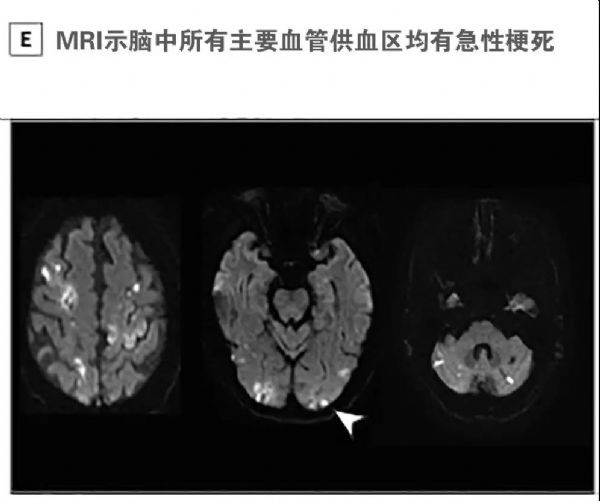
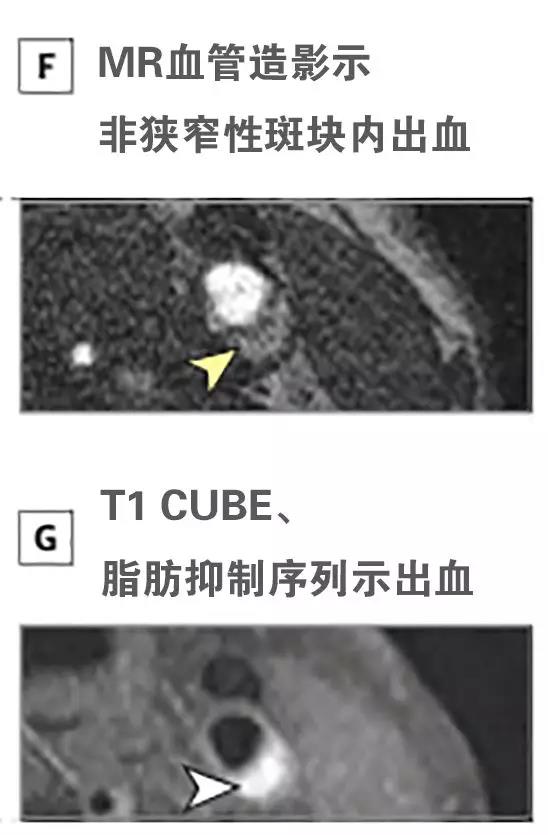
Semin Arthritis Rheu:系统性红斑狼疮患者卒中发生率和风险的种族差异
![]() 0
2019-04-21
点击查看
0
2019-04-21
点击查看

Neurology:根据年龄、亚型、性别的年轻人卒中发病率和时间趋势
![]() 0
2019-04-25
点击查看
0
2019-04-25
点击查看

Diabetes Obes Metab:减肥手术与心肌梗死和卒中后较低的死亡率相关
![]() 0
2019-05-05
点击查看
0
2019-05-05
点击查看

卒中患者的血糖如何管理?这张流程图在手,心中不慌
![]() 0
2019-05-06
点击查看
0
2019-05-06
点击查看
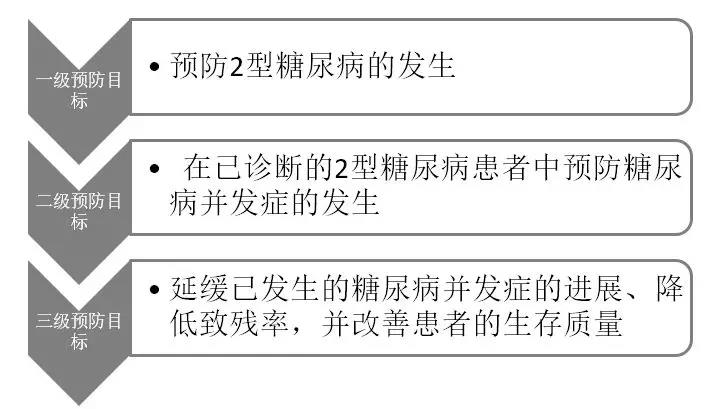
2019 ESO指南:卒中或短暂性脑缺血发作以及非瓣膜性房颤患者卒中和其他血栓栓塞事件二级预防抗栓治疗
![]() 0
2019-05-07
点击查看
0
2019-05-07
点击查看
Ann Neurol:卒中患者颅内血栓的组织病理学特征
![]() 0
2019-05-07
点击查看
0
2019-05-07
点击查看
