新冠肺炎药物Remdesivir(瑞德西韦)在2020年2月3日在中国开始临床试验,中日友好医院牵头
![]() 0
2020-02-01
点击查看
0
2020-02-01
点击查看

神速!Remdesivir治疗新型冠状病毒肺炎试验,1天就入组200例患者
![]() 0
2020-02-03
点击查看
0
2020-02-03
点击查看

Remdesivir(瑞德西韦)的临床试验昨日并未入组200例患者
![]() 0
2020-02-04
点击查看
0
2020-02-04
点击查看
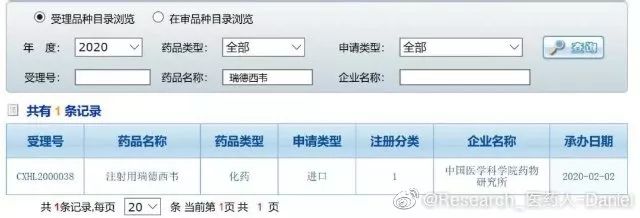
武汉病毒所抢先申请吉利德在研药物专利,饶毅说这是可以的
![]() 0
2020-02-07
点击查看
0
2020-02-07
点击查看

战疫中 - 单抗药和 Remdesivir 组合是救星吗?
![]() 0
2020-02-17
点击查看
0
2020-02-17
点击查看
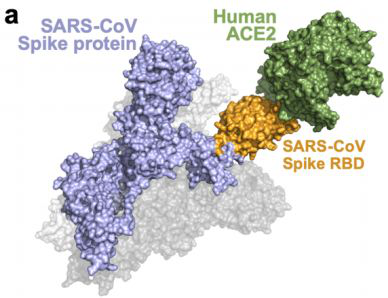
战疫中——单抗药和 Remdesivir 组合是救星吗?
![]() 0
2020-02-20
点击查看
0
2020-02-20
点击查看
