糖尿病视网膜病变( diabetic retinopathy,DR )是导致劳动年龄人群不可逆性视力丧失的主要原因。脂肪和肥胖相关蛋白( fat mass and obesity-associated protein,FTO )是一种N6-甲基腺苷( m6A )去甲基化酶,可使参与能量稳态的RNA去甲基化,但其对DR的影响尚不清楚。
2024年1月31日,南京医科大学刘庆淮及陈雪共同通讯在EMBO Molecular Medicine 上在线发表题为“Lactylation-driven FTO targets CDK2 to aggravate microvascular anomalies in diabetic retinopathy”的研究论文,该研究检测到增殖性DR患者玻璃体纤维血管膜中FTO表达升高,FTO促进内皮细胞( endothelial cells,ECs )的细胞周期进程和尖端细胞形成,从而促进体外、小鼠和斑马鱼的血管生成。FTO还通过调节EC-周细胞串扰触发糖尿病微血管渗漏,并介导EC-小胶质细胞相互作用在体内和体外诱导视网膜炎症和神经退行性变。
在机制上,FTO通过m6A-YTHDF2依赖的方式调节CDK2 mRNA的稳定性来影响EC特性。糖尿病条件下FTO的上调是由乳酸介导的组蛋白乳糖化驱动的。FB23-2是FTO m6A去甲基化酶活性的抑制剂,在体外抑制血管生成表型。为了便于全身给药,该研究开发了一种包裹FB23-2的纳米平台,并证实了其在小鼠体内的靶向性和治疗效率。总之,该研究表明FTO在DR中对EC功能和视网膜稳态具有重要作用,并作为DR患者的治疗靶点值得进一步研究。

糖尿病视网膜病变( diabetic retinopathy,DR )是糖尿病的主要微血管并发症,在工作年龄人群中已成为视力的主要威胁。临床上根据病程将DR分为早期和进展期。非增殖性DR ( NPDR )是DR的早期阶段,以血管通透性增加和毛细血管阻塞为特征。增生性DR ( Proliferative DR,PDR )是以新生血管形成为临床特征的DR的高级形式。NPDR患者可能无症状,但当发生玻璃体积血或牵拉性视网膜脱离时,PDR患者可能会出现严重的视力丧失。视网膜微血管病变、炎症和神经变性是DR的主要病理特征。微血管内皮细胞( endothelial cells,ECs )是高血糖损伤的主要靶点,在DR中研究较多。EC单层中细胞与细胞之间的接触丧失导致血-视网膜屏障( BRB )通透性增加,其转化为尖端细胞导致出芽血管生成。周细胞是神经视网膜微血管的另一个主要细胞成分。
微血管的形成、成熟和稳定需要EC -周细胞的相互作用,在DR中受到干扰,导致BRB破裂和其他微血管病变。糖尿病视网膜中稳态的中断诱导小胶质细胞活化和炎症反应,从而驱动持续的血管损伤,进一步导致血管通透性增加和血管新生。视网膜神经退行性变,尤其是视网膜神经节细胞( retinal ganglion cell,RGC )的轴突变性,是DR进展的最早事件之一。RGCs是对糖尿病诱导的应激反应最敏感的视网膜神经元,其缺失会导致严重的视觉障碍。目前DR的治疗方法主要有抗血管内皮生长因子( vascular endothelial growth factor,VEGF )药物玻璃体内注射、激光光凝和玻璃体切割术。抗VEGF药物是目前治疗NPDR和PDR的主要药物,但需要持续注射,且仅针对视网膜新生血管。许多DR患者在经过长期的抗VEGF药物治疗后,甚至表现出对抗VEGF药物的反应不足。因此,需要对DR的病理机制有新的认识,以确定新的治疗靶点。
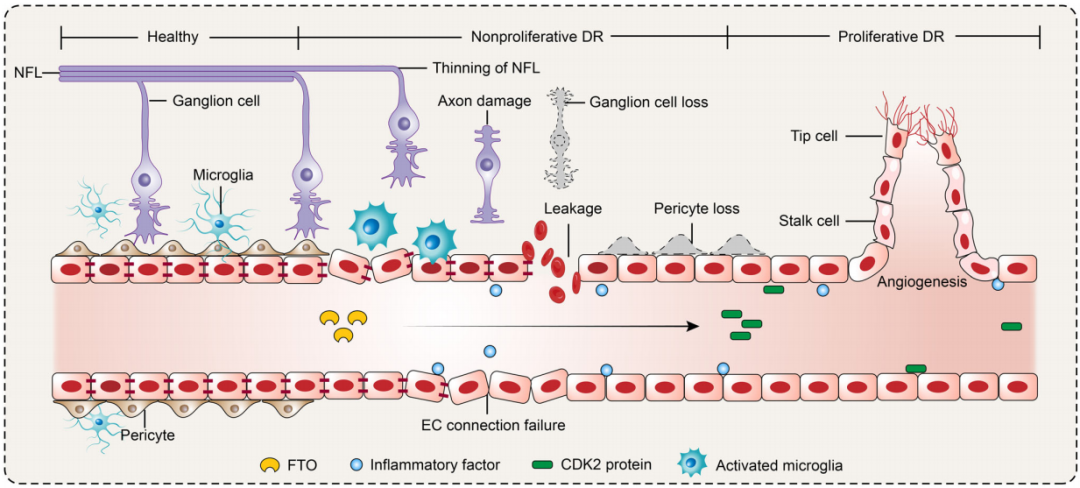
文章模式图(图源自EMBO Molecular Medicine )
N6-甲基腺苷( m6A )修饰主要由m6A甲基转移酶复合体( author )催化,被m6A去甲基化酶(橡皮擦)切除,并被m6A结合蛋白( reader )识别,是真核生物中最普遍和最丰富的mRNA内部修饰之一。它调节mRNA代谢,包括剪接、稳定性、翻译和核输出。越来越多的证据表明,m6A修饰水平及其调节剂(作家、擦写者和读者)的表达异常参与了DR的病理过程,暗示了m6A修饰在DR发病机制中的重要作用。脂肪量和肥胖相关蛋白( fat mass and fat-associated protein,FTO )介导不同RNA物种的氧化去甲基化,是脂肪量、脂肪生成和能量稳态的调节因子。尽管FTO与糖尿病之间的临床联系早已被讨论,但FTO在DR中的作用和调控网络仍不清楚。
基于此,该研究发现FTO促进内皮细胞周期进展和尖端细胞形成,从而促进DR中的血管生成。研究人员还发现FTO通过调节内皮细胞-周细胞对话触发糖尿病诱导的微血管渗漏。FTO还介导EC -小胶质细胞相互作用,通过诱导小胶质细胞活化和神经退行性变来破坏视网膜稳态。在机制上,FTO通过其去甲基化活性调节CDK2 mRNA的稳定性,以YTH结构域家族蛋白2 ( YTHDF2 )为阅读器调节糖尿病视网膜表型。糖尿病条件下ECs中FTO的上调是由乳酸通过组蛋白乳糖基化触发的。FB23-2直接与FTO结合,选择性抑制FTO的m6A去甲基化酶活性,从而抑制糖尿病诱导的内皮表型。该研究还开发了一种新型的巨噬细胞膜包被和聚乳酸-羟基乙酸共聚物( PLGA ) - 1,1′-双十八烷基- 3,3,3′,3′-四甲基吲哚羰花青高氯酸盐( Dil )为基础的纳米平台包载FB23 - 2用于全身给药。总之,该纳米平台的靶向性和治疗效率已被评估和证实,表明其作为DR治疗药物的前景。
参考信息:
https://doi.org/10.1038/s44321-024-00025-1
J Diabetes Res :轻度糖尿病视网膜病变患者中血浆脂肪因子对视力影响的预测模型
![]() 0
2023-11-06
点击查看
0
2023-11-06
点击查看
糖网科学防治 | 糖尿病或可治愈?中西合璧,终结“盛糖”时代
![]() 0
2023-12-05
点击查看
0
2023-12-05
点击查看
Nat Med:上海交通大学贾伟平/李华婷/盛斌等合作开发用于预测糖尿病视网膜病变进展时间的深度学习系统
![]() 0
2024-01-07
点击查看
0
2024-01-07
点击查看

民族之光,闪耀全球 | 首个成功“出海”的国产眼科生物制剂雷珠单抗注射液在欧盟获批,齐鲁制药向世界递出崭新的“中国名片”
![]() 0
2024-01-17
点击查看
0
2024-01-17
点击查看

Front Endocrinol:高血压、眼压和糖尿病视网膜病变的因果关系
![]() 0
2024-03-01
点击查看
0
2024-03-01
点击查看
BMC Ophthalmol :2型糖尿病患者血清白蛋白与糖尿病视网膜病变的非线性关系
![]() 0
2024-03-06
点击查看
0
2024-03-06
点击查看
