腹主动脉瘤(abdominal aortic aneurysm, AAA)是一类致命的、不可逆的主动脉扩张性血管疾病,通常始于肾动脉(肾下)并高发于腹主动脉,大多数AAA患者瘤体破裂前无明显临床症状,因而极大阻碍了AAA的早期诊断。主动脉血管壁结构破坏、弹性层退化和中膜层血管平滑肌(VSMC)病变丢失是腹主动脉瘤(AAA)的主要病理特征之一。血管平滑肌细胞(VSMCs)是动脉中层的主要细胞,VSMCs具有高度的表型可塑性,其中收缩表型的丧失被认为是AAA的主要起始事件。激活转录因子3 (Activating transcription factor 3, ATF3)是一种适应性反应基因,属于转录因子ATF-cAMP反应元件结合(CREB)蛋白家族,既往被报道作为转录抑制因子或转录激活因子调控细胞对外界刺激的反应,参与细胞增殖、分化、凋亡等重要生物学过程。新近证据表明,ATF3作为一种关键的心血管疾病相关基因,通过改变其在染色质可及性上的结合位点调控疾病不同阶段时VSMCs的表型转换。然而,ATF3在AAA发生发展中的作用尚未得到深入研究。
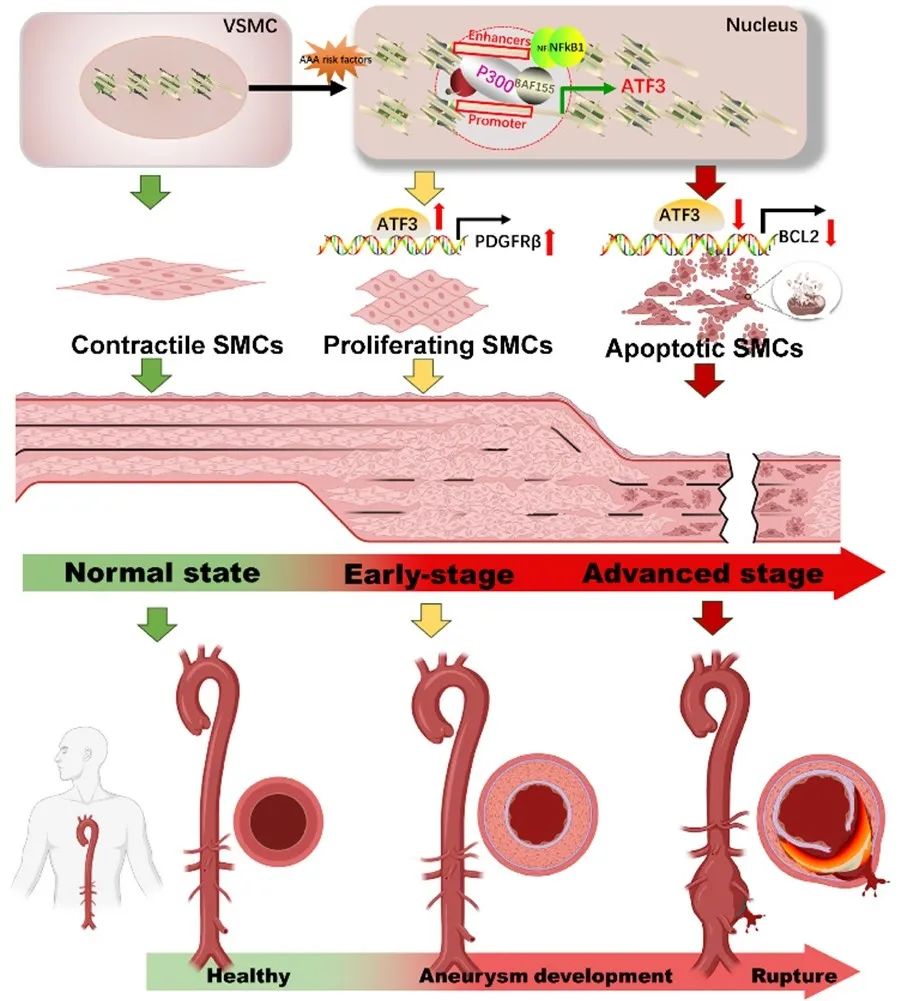
2024年4月30日,广州医科大学附属妇女儿童医疗中心邓伟豪、张媛团队在Circulation Research杂志在线发表了题为“Spatiotemporal ATF3 Expression Determines VSMC Fate in Abdominal Aortic Aneurysm”的研究论文。本研究首次揭示血管平滑肌细胞ATF3在腹主动脉瘤形成过程的时空异质性作用,发现ATF3在AAA患者和AngII诱导的AAA鼠模型的腹主动脉瘤组织中相对性低表达,而在主动脉损伤病变(未成瘤)组织中高表达。在AAA成瘤早期,上调的ATF3通过与PDGFRB启动子区域结合促进去分化基因PDGFRB的转录表达;而在AAA成瘤进展期,下调的ATF3通过减少其与BCL2启动子区域结合下调抗凋亡基因BCL2的转录表达,进而促进线粒体依赖性凋亡。研究者进一步发现,NFκB1/ P300/BAF/H3K27ac形成增强子复合物可募集到ATF3启动子区域来调节ATF3及其下游基因(PDGFRB和BCL2)转录,进而驱动VSMCs表型转换和线粒体依赖性细胞凋亡,最终导致AAA的发生发展。本文揭示的NFκB1-ATF3-PDGFRβ/BCL2信号轴可能为AAA的早期防控及靶向治疗提供新的见解。

首先,研究者为了探究AAA主动脉基因组异质性分布,从假手术和AngII诱导的AAA小鼠主动脉中分离出对照(control)、主动脉病变(aortic lesion)和AAA (abdominal aortic aneurysm)组织进行RNA测序(RNAseq)分析;并通过数据库(GSE166676)分析了3例腹主动脉瘤患者非动脉瘤组织(瘤旁组织: control)、AAA 组织的单细胞RNA测序(scRNA-seq)数据发现,关键基因ATF3主要表达于VSMCs,提示ATF3可能参与动脉瘤形成的发生发展,其下调促进瘤体形成(Figure S1-S2)。同时,在临床患者样本和AngII诱导的AAA小鼠中均发现,与对照组相比,ATF3在病变(非动脉瘤)主动脉段的表达相对增加伴细胞增殖标志物Ki67表达增加;而与病变(非动脉瘤)主动脉段相比,ATF3在动脉瘤切段的表达显著降低伴凋亡标志物Cleaved caspase-3表达增加。为了探索ATF3在不同主动脉的异质性表达,研究者从小鼠中分离出腹主动脉、胸主动脉、颈动脉、桡动脉和股动脉发现,腹主动脉中ATF3的基础表达最低,且ATF3在腹主动脉中变化波动最大,提示ATF3可能是腹主动脉成瘤的关键驱动基因(Figure 1)。
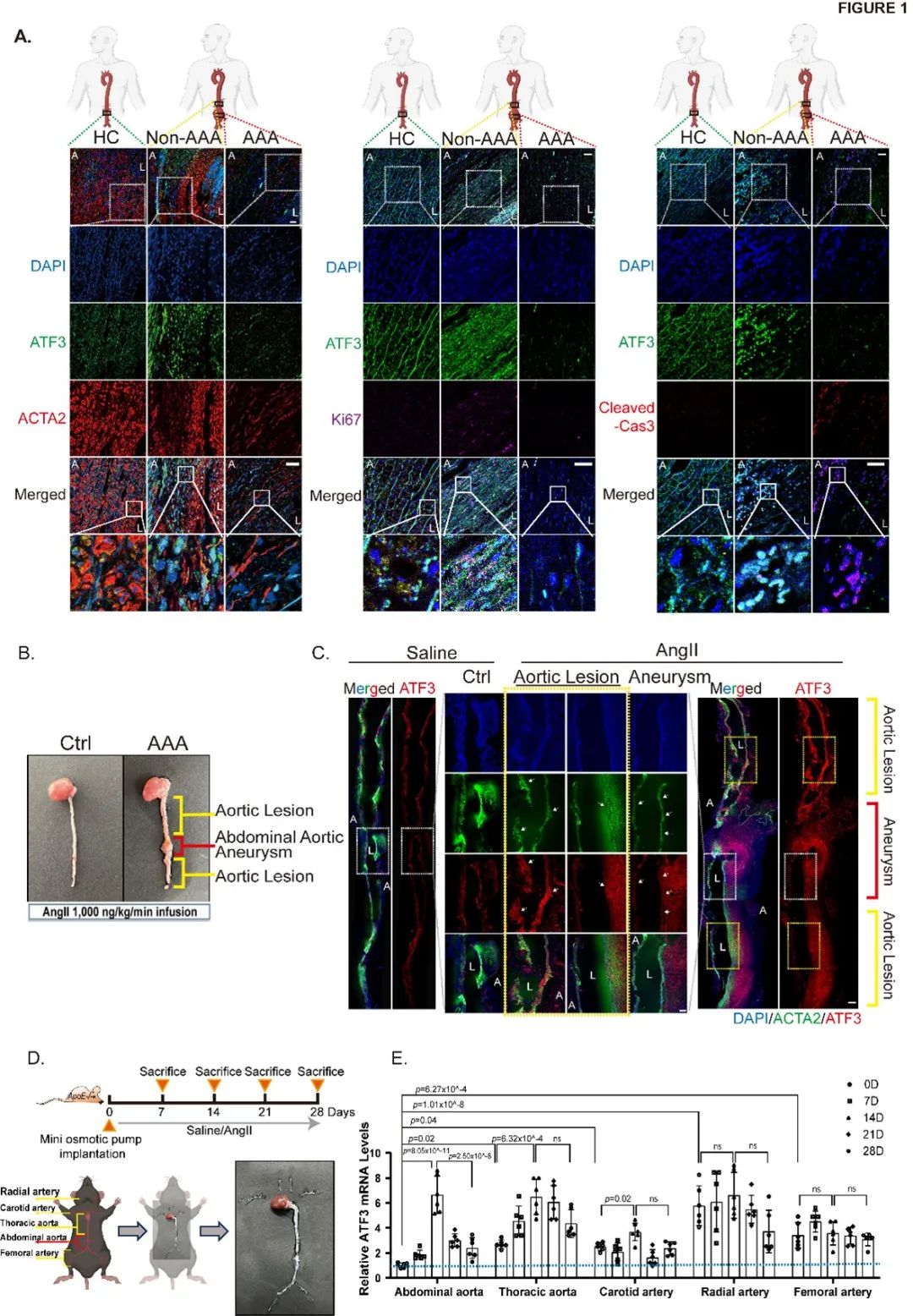
进一步探索ATF3在腹主动脉中的空间特异性,研究者构建了血管平滑肌细胞特异性敲低或过表达小鼠。实验结果表明,平滑肌特异性敲低小鼠AAA成模率及死亡率明显升高。进一步在AngII诱导的AAA小鼠中特异性敲低一侧颈动脉段ATF3表达,发现该颈动脉段出现异常的瘤样扩张。综上结果表明,ATF3在AAA的形成中起着至关重要的作用 (Figure S3-S4,Figure 2)。
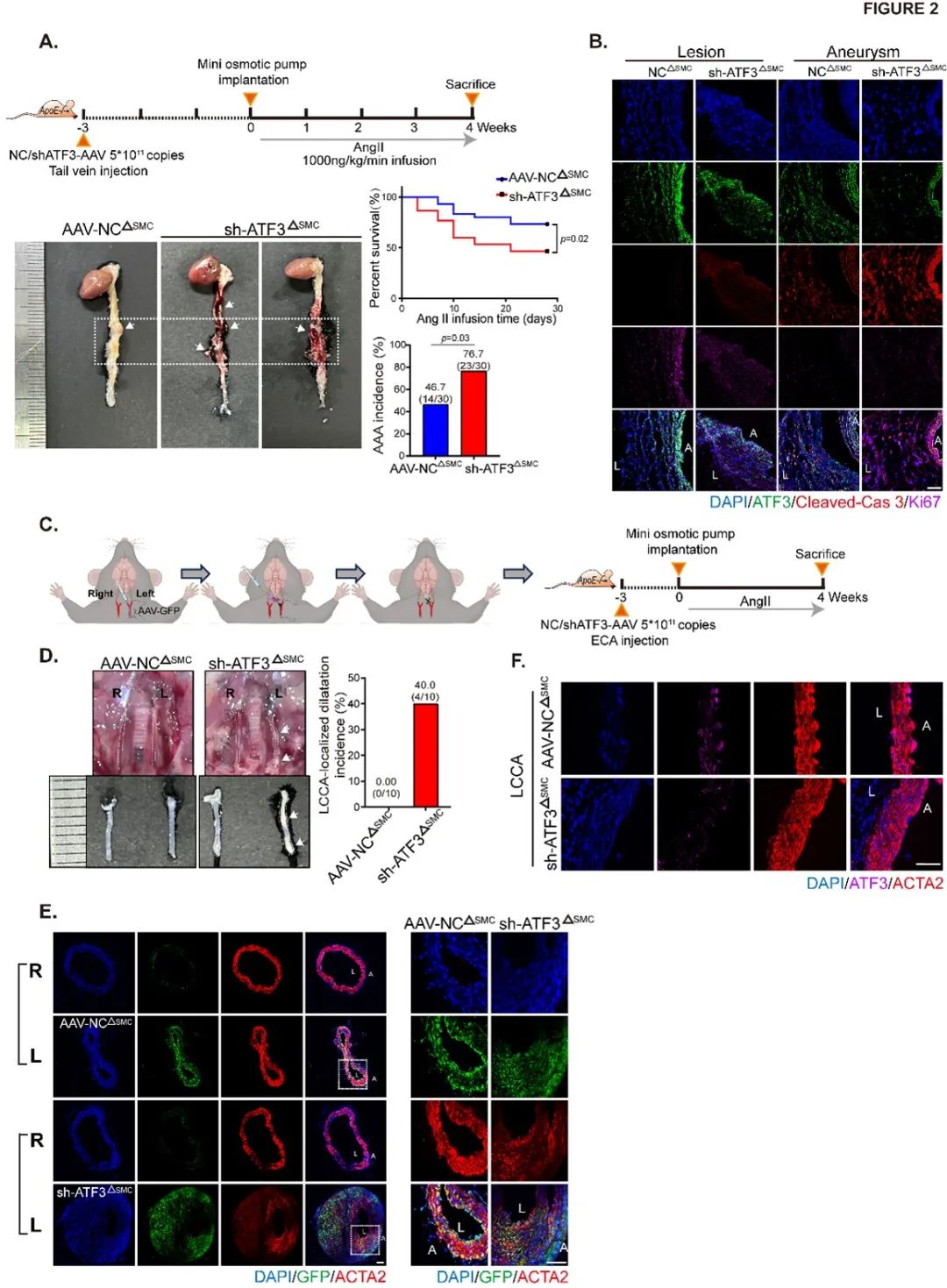
为了探索ATF3在AAA进展中的时间特异性表达,研究者构建了AngII诱导的不同时间段AAA小鼠模型,发现ATF3在AAA的发生过程中起着保护作用:在成瘤早期,ATF3增加促进VSMC增殖以稳定主动脉壁结构;而在成瘤进展期,ATF3显著降低,促进caspase 3依赖性细胞凋亡,导致VSMC缺失和主动脉壁减弱(Figure S5-S7)。机制研究发现,在成瘤早期ATF3受炎症因子TNF-α调控,ATF3通过与去分化基因PDGFRβ启动子区域结合促进PDGFRβ的转录表达(Figure 3)。
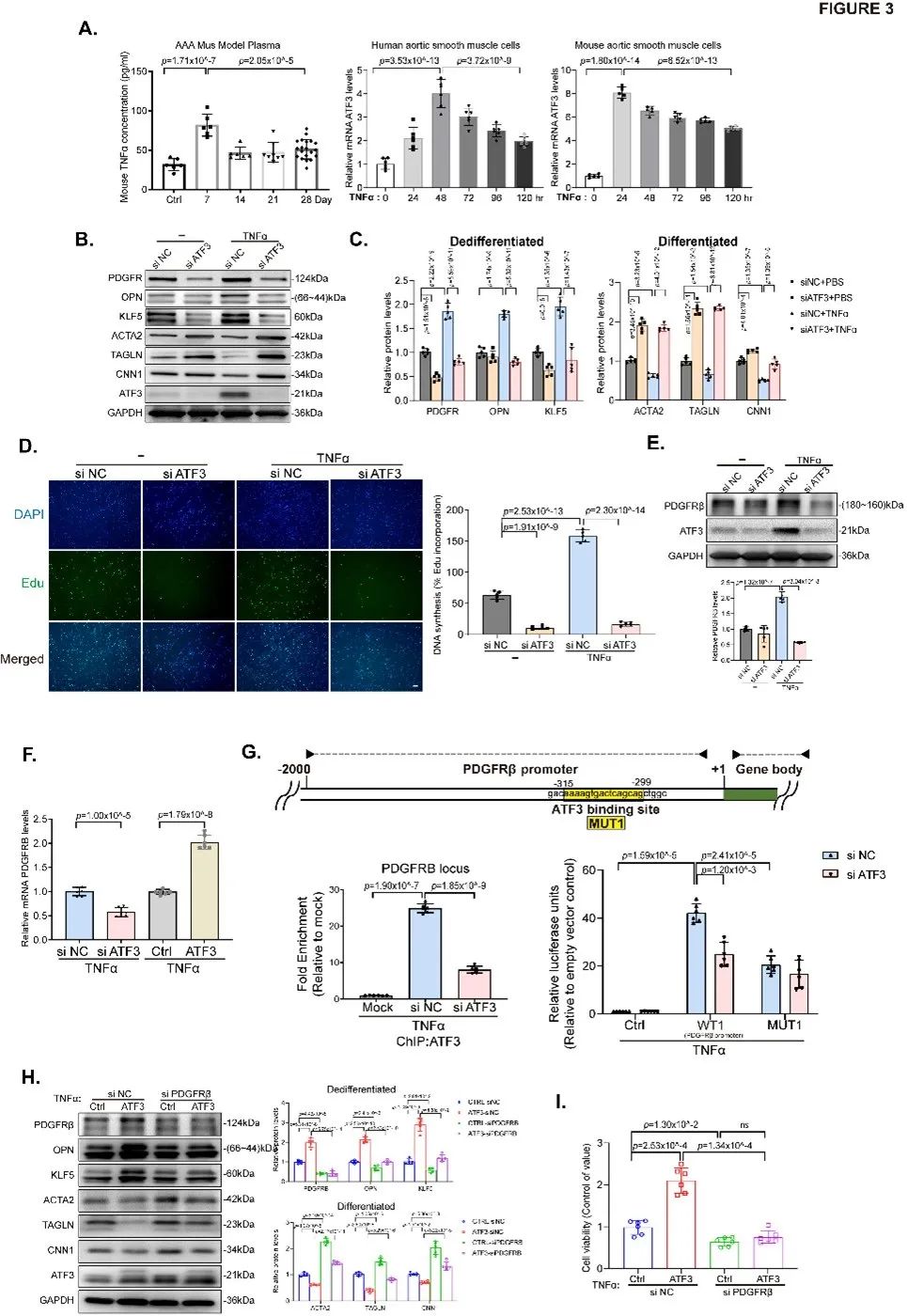
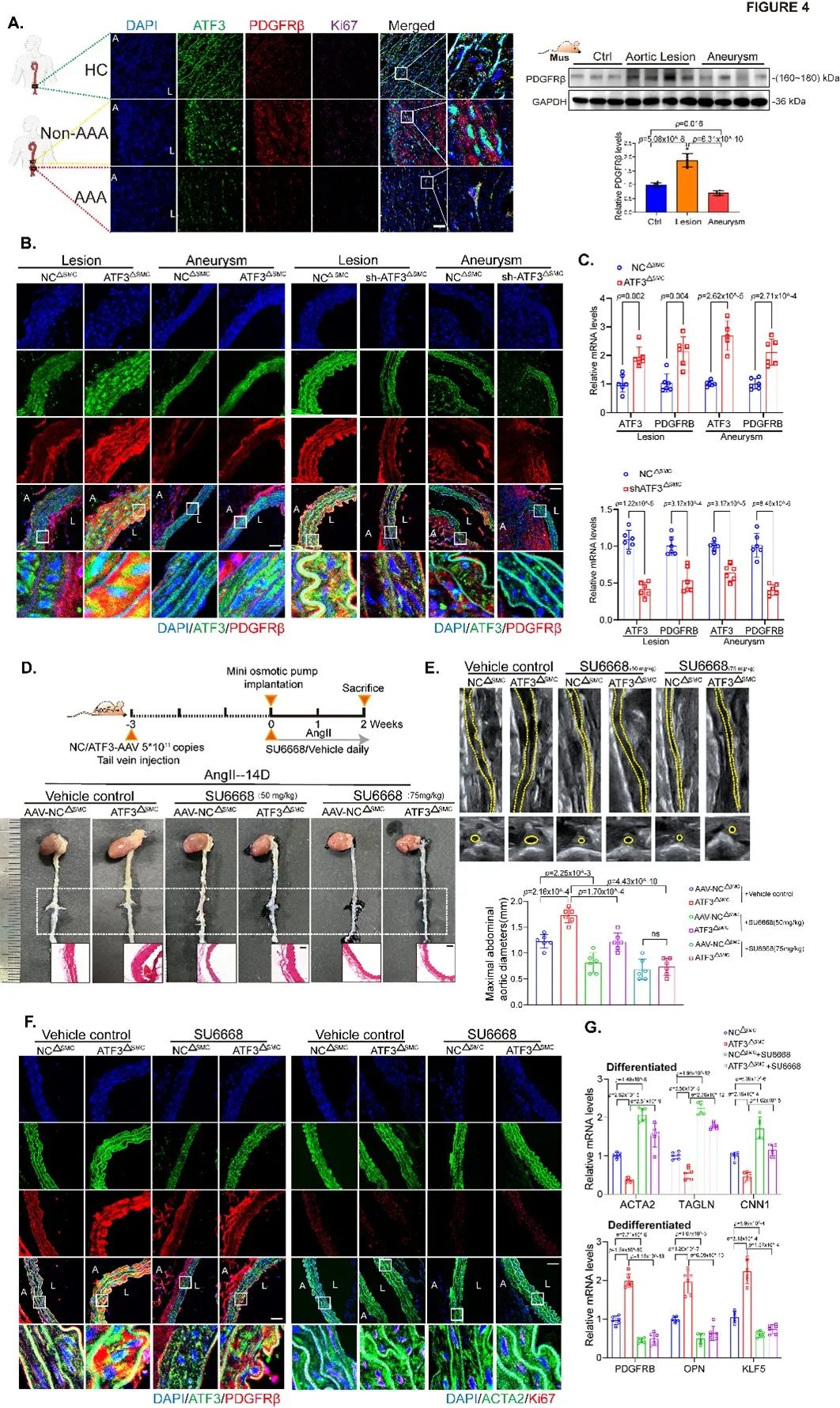
通过构建AAA成瘤早期小鼠模型并在腹腔注射PDGFRβ抑制剂,体内证实AAA早期ATF3通过上调PDGFRβ的转录表达促进VSMC去分化及增殖(Figure 4)。
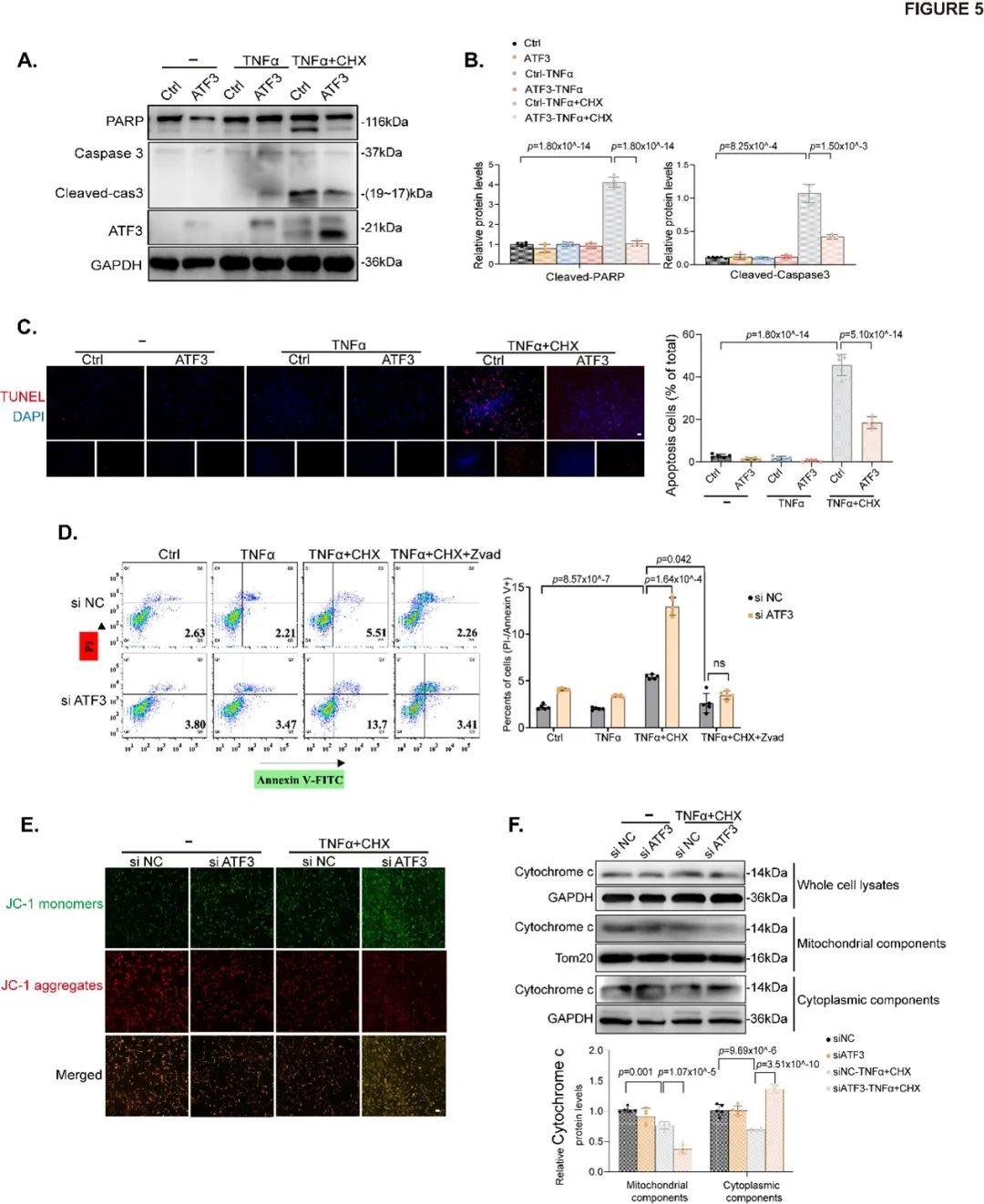
为探索成瘤进展期,ATF3缺失促进caspase-3依赖性细胞凋亡进而导致AAA形成的潜在机制,研究者通过体外实验(人原代主动脉平滑肌和小鼠原代主动脉平滑肌)发现,ATF3缺失诱导的线粒体功能障碍与凋亡相关蛋白BCL2密切相关(Figure 5;Figure S8-S12)。
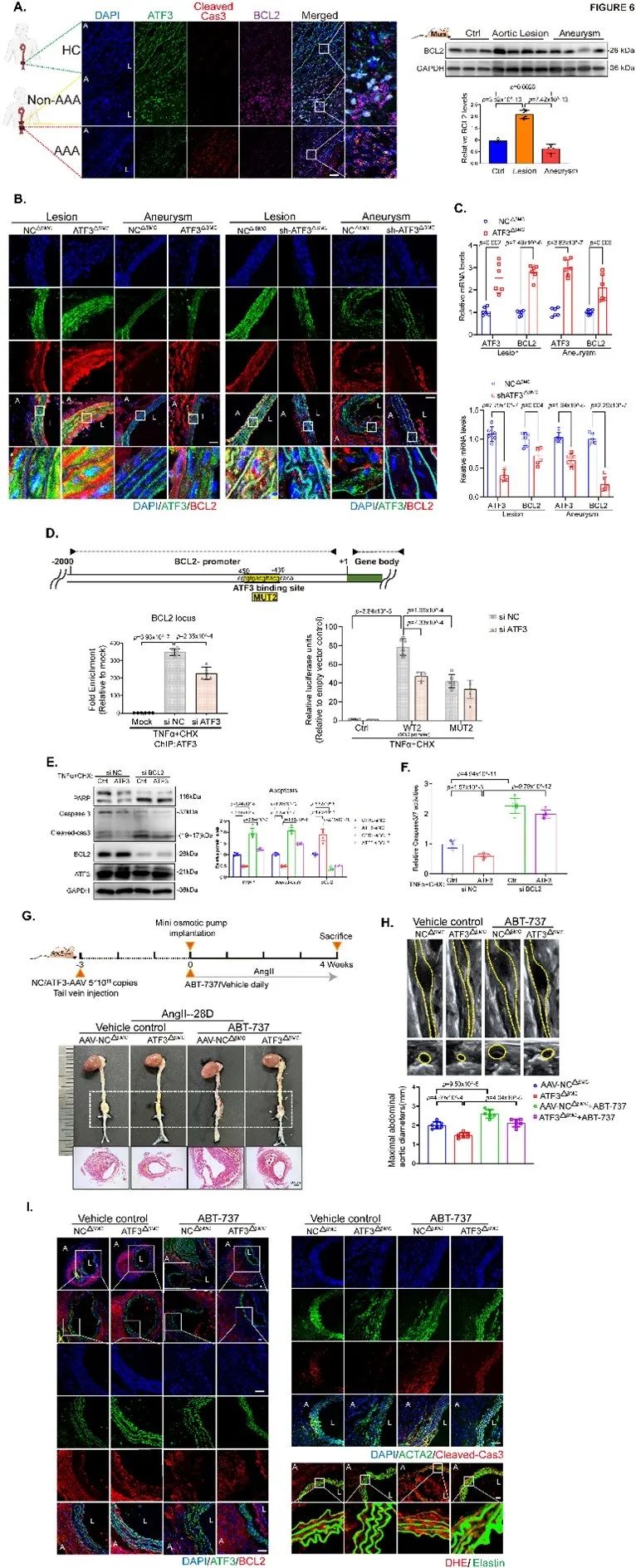
进一步研究者采用BCL2抑制剂体内证实,AAA进展期ATF3缺失通过下调BCL2的转录表达促进VSMC线粒体依赖性凋亡最终导致瘤体形成(Figure 6)。
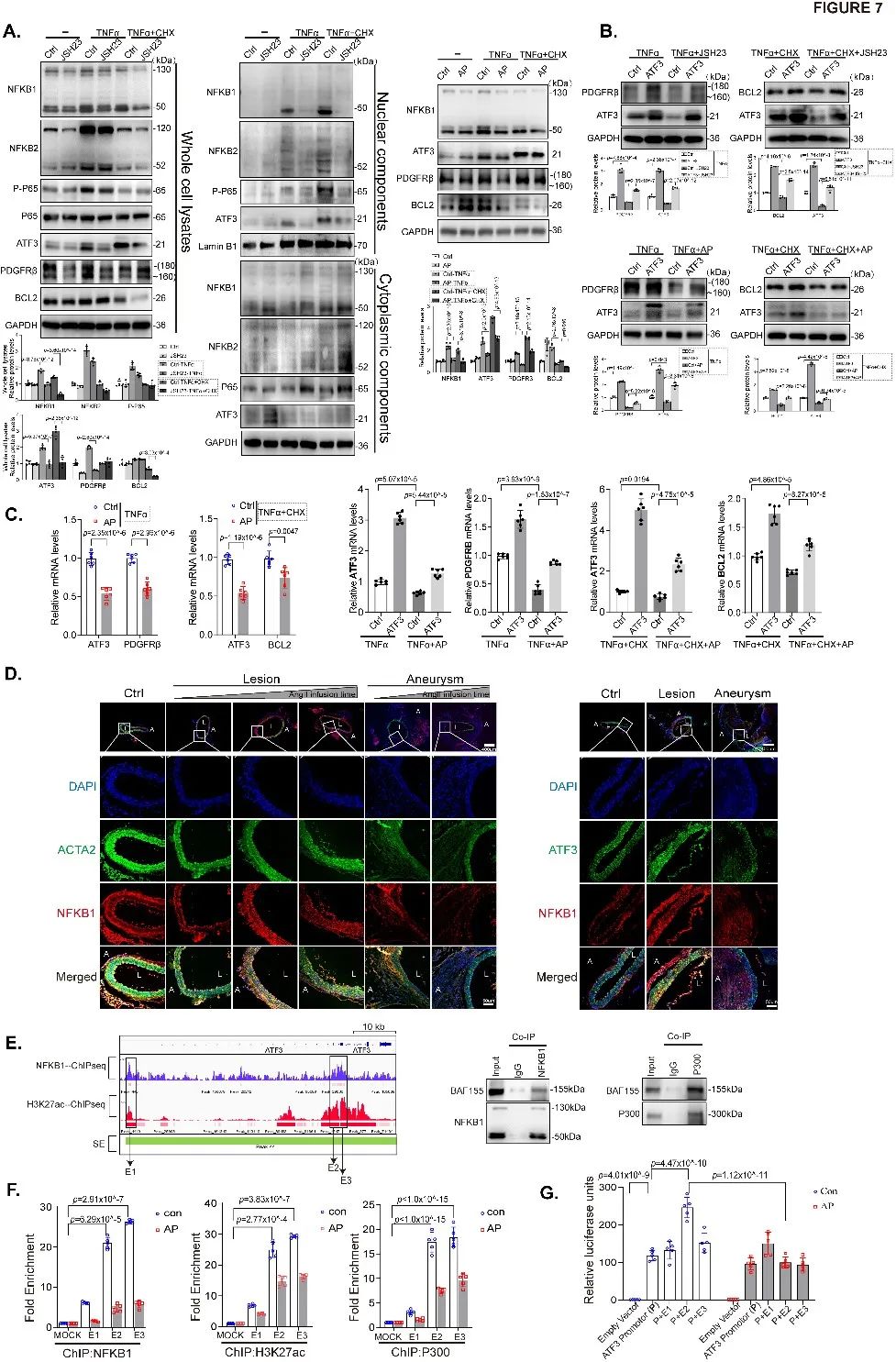
NF-κB通路对于在病理情况下维持VSMC稳态至关重要。前期测序数据表明,组间差异表达基因主要富集于通过NF-κB(活化B细胞的核因子Kappa轻链增强子)途径传递的TNFα信号通路中,表明NF-κB途径可能参与AAA的形成和发展。通过ChIP-seq及ChIP-qPCR等实验发现,NFκB1/P300/BAF/H3K27ac形成增强子复合物可募集到ATF3启动子区域来调节ATF3及其下游基因(PDGFRβ和BCL2)转录表达(Figure 7)。
综上所述,该研究发现在人和小鼠腹主动脉瘤中, VSMC-ATF3在AAA组织中相对低表达,而在主动脉损伤病变(未成瘤)组织中高表达。在AAA成瘤早期,上调的ATF3通过与PDGFRB启动子区域结合促进去分化基因PDGFRB的转录表达;而在AAA成瘤进展期,下调的ATF3通过减少其与BCL2启动子区域结合下调抗凋亡基因BCL2的转录表达,进而促进线粒体依赖性凋亡,最终导致AAA的发生发展。在机制上,NFκB1/P300/BAF/H3K27ac形成增强子复合物可募集到ATF3启动子区域调控ATF3基因的表达。该研究首先发现ATF3是AAA发生发展过程中关键基因,揭示的NFκB1-ATF3-PDGFRB/BCL2信号轴可能为AAA的早期防控及靶向治疗提供新思路。
广州医科大学附属妇女儿童医疗中心博士后文莹、刘莹莹为该文的共同第一作者,广州医科大学附属妇女儿童医疗中心邓伟豪教授、张媛副教授和中国科学院上海巴斯德研究所潘磊教授为文章的共同通讯作者。该工作得到多项国家自然科学基金和广州市科技计划项目资助。
原文链接:
https://www.ahajournals.org/doi/abs/10.1161/CIRCRESAHA.124.324323
Eur Heart J 华中科技大学公共卫生学院田耀华团队揭示大气污染、遗传易感性对腹主动脉瘤的影响
![]() 0
2024-01-23
点击查看
0
2024-01-23
点击查看

Adv Sci 山东大学齐鲁医院张澄/张运/章萌团队发现β2受体激动剂福莫特罗抑制腹主动脉瘤的有益作用
![]() 0
2024-02-18
点击查看
0
2024-02-18
点击查看

Adv Sci:张澄/张运/章萌团队发现β2受体激动剂福莫特罗抑制腹主动脉瘤的有益作用
![]() 0
2024-02-19
点击查看
0
2024-02-19
点击查看
ACS NANO 陆军军医大学张建祥/丁俊教授团队揭示NETs抑制性纳米药物靶向治疗腹主动脉瘤的作用与机制
![]() 0
2024-04-01
点击查看
0
2024-04-01
点击查看

Circulation 上海交通大学医学院附属仁济医院卜军教授团队发现代谢性核受体LXRα促发腹主动脉瘤形成
![]() 0
2024-04-02
点击查看
0
2024-04-02
点击查看

ACS Nano:张建祥/丁俊教授团队发现一种新型纳米药物靶向治疗腹主动脉瘤
![]() 0
2024-04-05
点击查看
0
2024-04-05
点击查看