前 言
乳腺癌是女性常见的恶性肿瘤之一,CA153是目前应用最广的乳腺癌肿瘤标志物之一,常用于乳腺癌诊断、术后监测,但是CA153增高就一定是乳腺癌嘛?答案是否定的。
例如下图:

患者为59岁女性,诊断为乳腺癌,CA153水平增高,且增长趋势逐渐增高,这次入院诊断为乳腺癌复发并多处转移。
那下面这两个患者CA153增高是乳腺癌嘛?
案例经过
患者一:

患者二:

这两个患者CA153都增高(审核报告前均已复查,室内质控均在控),会是乳腺癌嘛?显然不太可能,患者均为男性, 且住院诊断里,并无发现恶性肿瘤的线索,也无相关肿瘤的诊断,其他部分检查结果如下:
患者一:
血常规:血红蛋白:30g/L,↓平均血红蛋白量:34.10pg,平均血红蛋白浓度:357.0g/L,平均红细胞体积:95.5fL,中性细胞数:0.3×10^9/L,中性细胞比率:48.5%,血小板:5×10^9/L,↓红细胞:0.88×10^12/L,↓白细胞:0.66×10^9/L;↓1肝功能:总蛋白:53.9g/L,↓总胆红素:36.80umol/L,↑直接胆红素:17.60umol/L,乳酸脱氢酶:1175U/L,↑,间接胆红素:19.20umol/L,↑;DAT:直接抗人球蛋白实验:阴性;促红细胞生成素测定:促红细胞生成素(EPO):>758.00mIU/mL;↑维生素B12(VitB12):<37.00pmol/L,↓叶酸: 1.3ng/mL;↓其余基本正常,心电图:窦性心动过速。骨髓细胞学:骨髓象考虑巨幼细胞性贫血MDS待排,请结合临床并完善营养性贫血等相关检查。
患者二:
血常规:白细胞:5.02×10^9/L,中性细胞数:3.4×10^9/L,中性细胞比率:67.1%,红细胞:0.68×10^12/L,↓血红蛋白:40g/L,↓平均红细胞体积:159.4fL,↑平均血红蛋白量:58.90pg,↓平均血红蛋白浓度:370.0g/L,血小板:123×10^9/L:B型-尿钠肽:736pg/mL;1肝功能:间接胆红素:52.50umol/L,↑总蛋白:58.3g/L,↓总胆红素:71.30umol/L,↑直接胆红素:18.80umol/L,↑AST:62.9U/L,↑乳酸脱氢酶:805U/L,↑尿酸:637umol/L,↑,CRP:8.00mg/L;↑;1RHD+2KTJD+3RH+4ABOW:血型单特异性抗体筛查:阳性,DAT:直接抗人球蛋白实验:阳性(4+);网织红细胞计数:33.00%;叶酸:3.00ng/mL,↓,其余基本正常,心脏B超:左房大,左室壁增厚,肺动脉高压,心包积液,主动脉瓣射流速度增快,主动脉瓣钙化并少量返流,二尖瓣、三尖瓣少量返流,左室舒张功能减退
患者一诊治过程:
因“乏力10余天,间断发热5天”为行进一步诊治入院,血常规提示三系减低,血红蛋白30g/L,接近极重度贫血,入院后骨髓细胞学检查提示,考虑巨幼细胞性贫血,MDS待排,叶酸跟维生素B12检查均低于检测下限,入院后经过输血,以及补充造血原料,血红蛋白上升较快,10天左右血红蛋白上升至92g/L,17天左右,血红蛋白恢复正常,提示治疗有效,血清生化检查:胆红素轻度增高,间接胆红素为主,乳酸脱氢酶1175U/L,出院诊断为巨幼红细胞性贫血。
患者二诊治过程:
因反复头昏、乏力1年余,加重伴胸闷、气促半月。为行进一步诊治入院,既往有"高血压病"病史10余年,有“冠心病”病史1年余,入院前门诊血常规提示重度贫血,血清生化检查:,总胆红素:71.30umol/L,直接胆素:18.80umol/L,间接胆红素:52.50umol/L,乳酸脱氢酶:805U/L,直接抗人球蛋白实验:阳性(4+),BNP增高,提示心功能不全合并心衰,其余检查结果均大致正常,住院期间糖皮质激素有效,经过治疗后,全血细胞明显升高,随后患者要求出院。出院诊断为溶血性贫血(自身免疫性)。
案例分析
两个患者都存在相同的共同点;都为男性,CA153都增高,且都就诊于血液肿瘤内科,怀疑血液疾病,体内都存在溶血状态,临床上都无证据支持肿瘤。
患者一血常规提示三系减低,MCV正常,但是在住院治疗过程中,上升至100fl以上,胆红素轻度增高,间接胆红素增高为主,LDH增高幅度大,经骨髓细胞学检查诊断为巨幼红细胞性贫血,贫血类型为大细胞性贫血,患者二MCV增高明显,属于典型的大细胞性贫血,血红蛋白下降幅度大,胆红素增高明显,以间接胆红素增高为主,LDH增高,网织红细胞计数增高明显,符合溶血性贫血特点,后经诊断为溶血性贫血,溶血病因为自身免疫性溶血,两者CA153都增高,且都无证据支持肿瘤,那会是什么原因导致的?
两者都有其共同点:大细胞性贫血,体内都存在溶血状态,胆红素增高,以间接胆红素为主。那会是大细胞贫血会导致CA153增高嘛?为了验证猜想,我找了三个血常规MCV增高的,且叶酸都减低的,提示大细胞贫血的患者检测CA153,结果都显示为正常的,故此猜想不成立,随即考虑是溶血性黄疸导致CA153增高?
于是又找寻3个总胆红素增高,且以间接胆红素增高为主和2个MCV正常,LDH增高的肉眼显示溶血的标本检测CA153,检测还是正常的,此猜想也不成立,后查阅CA153试剂说明书,上面也写明轻中度黄疸跟溶血不会对结果存在影响,实验中的溶血,黄疸水平远没有达到说明书上干扰的限定值。
难道是同时具备大细胞性贫血,且都存在溶血性黄疸时候,CA153才会增高嘛?或者是巨幼红细胞性贫血会导致CA153增高?于是在LIS系统查询类似的患者,其中两例在血液肿瘤内科经骨髓细胞学检查诊断为巨幼性细胞贫血(维生素B12缺乏相关的巨幼贫),血常规三系减低,MCV增高明显,但是生化结果显示总胆红素,间接胆红素正常,CA153检测结果正常。
在一定程度上提示单纯巨幼红细胞性贫血不会导致CA153增高,需合并存在溶血情况下会导致CA153增高?可惜并未在LIS系统中查询到巨幼红细胞合并溶血性黄疸,同时还找到一例血液科的大细胞性贫血合并溶血的患者,诊断为溶血性贫血,其CA153检测为55.80U/L,处于增高水平,跟患者二的情况类似,于是动态追踪几个符合条件的患者CA153的检测情况。如下
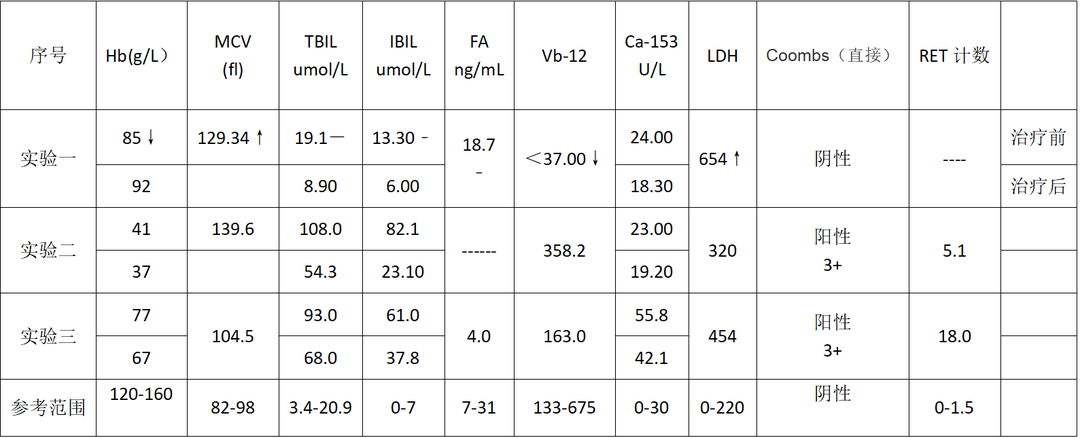
结果显示实验一患者,大细胞贫血确诊为巨幼性红细胞贫血其CA153结果虽然未超过上限范围,但是由于不清楚患者正常情况下的CA153基础水平多少,所以无法判断第一次CA153的结果是由于病情上升导致的还是本来的基础水平,但是在治疗后,随着间接胆红素的降低CA153也有所降低,虽然幅度不大。
实验二跟三均为大细胞贫血确诊为溶血性贫血,都为男性老年患者,实验二的CA153结果情况跟实验一差不多,实验三CA153超过正常范围,跟前文的患者二的情况类似,再者查阅部分中老年男性患者,无血液疾病,无肿瘤病史的CA153水平,发现基本都在10U/L以下,比上述实验一,二CA153水平都要低。
从实验数据来看,在巨幼红细胞性贫血和溶血性贫血情况下,部分患者CA153水平超过正常范围,未超过范围的其CA153水平由于不清楚其基础水平多少,但是还是相对来说处于一个增高的数值,但是无论是否超过正常范围,都随着病情的治疗,溶血状态的减轻,CA153水平都出现下降。
表明CA153的变化跟病情还是有一定相关性的。考虑到CA153的半衰期为8-15天,以及检测过程中的误差,最好的验证方式是等患者病情恢复到正常,再来检测CA153,此时若CA153水平下降幅度大,或者由原来的增高下降到正常值,则表明CA153增高跟巨幼红细胞贫血和溶血性贫血之间存在密切联系。
有研究显示CA153不仅在乳腺癌表达,在红系细胞中也发现了显着的表达,尤其是在不成熟的红细胞中,并且在巨幼性细胞贫血的骨髓上清液CA153水平显着增高[1],据此推测本文两个患者跟实验数据中的CA153增高可能是由于存在不成熟的红细胞并且合并溶血导致增高的。
患者均为大细胞性贫血,骨髓细胞学检查都提示红系存在病态造血,都出现未成熟红细胞比例增高,伴有幼红细核畸形,大小不一等,患者一是由于叶酸跟维生素B12缺乏引起巨幼红细胞性贫血,在骨髓中造血过程中出现无效造血,导致部分幼红细胞破坏出现原位溶血现象,出现溶血性黄疸。
这种情况下的黄疸一般比较轻,同时使CA153进入到血液里,导致血液CA153增高,患者二和实验三是由于溶血性贫血,骨髓出现增生性的贫血,超过骨髓的代偿能力,使部分未成熟的红细胞释放进入血液,然后未成熟的红细胞遭到破坏,发生溶血性黄疸,致使CA153增高。
再者长期的溶血使骨髓造血对叶酸的需求量大,当叶酸出现减低时,骨髓造血也会出现类似巨幼红细胞贫血的特点,三者骨髓都出现红系病态造血也能在一定程度体现出来,在这两者的叠加下CA153水平上升的更高,具体升高机制尚未明确,还需要深入研究。
可惜在本文编写期间,并未发现患者来复诊,故无法验证。回顾本文中患者情况,结合实验数据, 此间CA153增高在一定程度上显示跟大细胞性贫血合并溶血存在联系,但由于相关案例数据太少,且验证过程中存在不足,只供参考阅读。
知识拓展
一项临床研究[2]显示;251例大细胞性贫血患者中,巨幼细胞贫血( MA) 85 ( 33.86% ) ,溶血性贫血( HA) 18 例( 7.17% ) ,,急性白血病( AL) 41 例( 16.33% ) ,再生障碍性贫血( AA) 30 例( 11.95% ) ,骨髓增生异常综合征( MDS) 30 例( 11.95% ) 。
各病因患者平均红细胞体积( MCV) 和红细胞体积分布宽度(RDW)比较结果显示,MA及HA组MCV值显着升高,FA、VitB12、SF及CA153水平比较: MA 和HA组的CA153明显升高( P <0.01),70例MA患者行血清CA153检测,其中52例( 74.29% ) 有不同程度升高; 16 例HA患 者 行 CA153检 测,其 中 10例( 62.50% ) 出现增高。详细见下图:
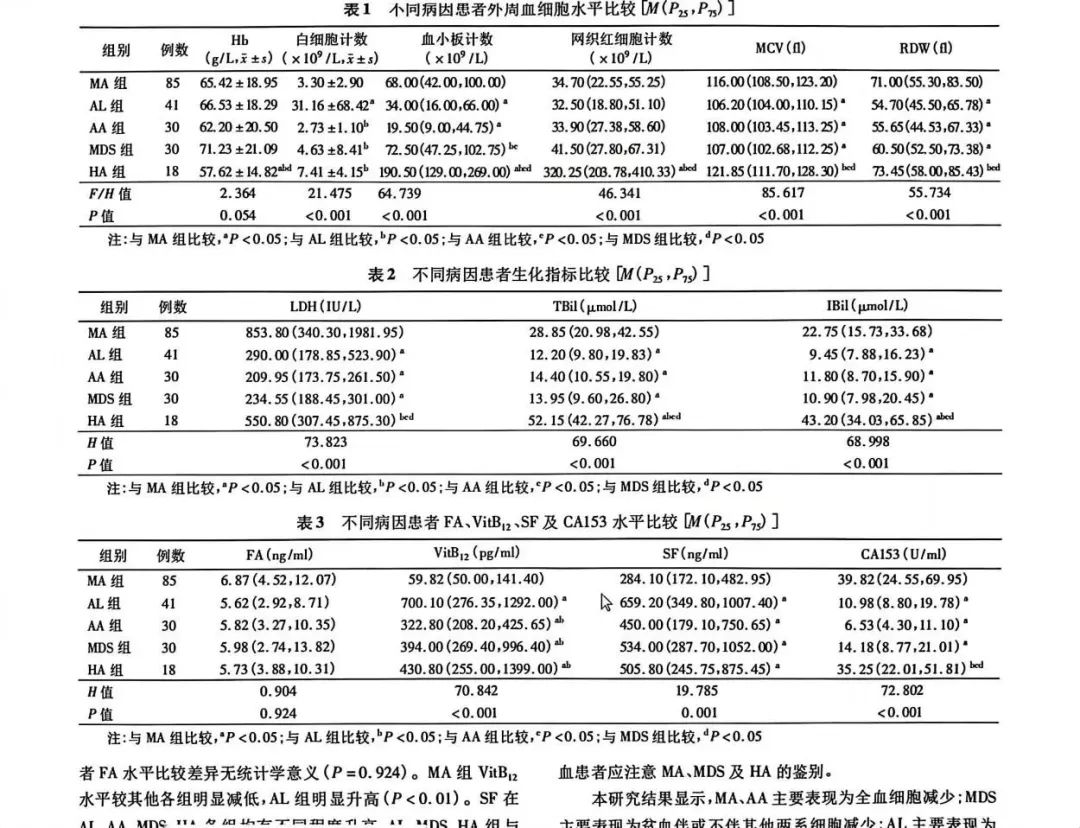
本研究结果显示,MA及HA组患者的LDH升高,可能与两种疾病均可导致细胞破坏、大量LDH释放入血有关。有研究发现,LDH是诊断MA的敏感指标,其阳性率达100%,因此血清LDH检测有助于MA及HA的诊断。也有研究表明LDH水平与HA的严重程度密切相关。
本研究中,MA及HA组患 者均存在不同程度 TBil及IBil升高,且在HA组升高最为明显。74.29%的MA患者伴有不同程度的CA153升高。CA153作为一项肿瘤标志物,其水平增高常被认为与一些肿瘤相关性疾病有关,但在临床工作中,大多数CA153增高的MA患者进一步行相关检查后并未发现肿瘤的线索。
目前多项研究结果显示,MA患者治疗前CA153水平明显升高,经补充造血原料后,CA153可下降至正常。因此CA153升高不一定提示肿瘤相关性疾病,但其可作为MA的一项早期诊断指标。
本研究中,62.50%的HA患者也出现血清CA153增高。有研究结果显示,CA153水平与LDH水平呈正相关,CA153的异常增高可能与MA或HA的严重程度呈正相关。因此,对于CA153增高的重度大细胞性贫血患者,如同时伴有网织红细胞计数、MCV、RDW、LDH、IBil水平升高,要注意排除HA。本文中患者的情况基本上跟此研究相符合。
巨幼细胞性贫血(MA)是由于血细胞脱氧核糖 核酸(DNA)合成障碍所致的一种大细胞贫血,其特征是骨髓中红细胞和髓细胞系出现“巨幼变”。叶酸 和(或)维生素B12参与细胞核DNA的合成,一种或两种的缺乏是MA的最常见病因[3],骨髓内的幼红细胞在释放入血液循环之前已在骨髓内破坏,称为原位溶血,可伴有黄疸,其本质是一种血管外溶血,常见于巨幼细胞贫血等。
LDH是一种存在于很多组织或血细胞中的糖酵解酶,在正常人血液中含量很少,但在红细胞中其含量较血清中高1000倍。当血细胞或组织细胞破坏时,可将该酶释放入血,导致其血清中水平增高[4],MA患者出现黄疸、LDH增高主要与骨髓原位性溶血、红细胞破坏增加有关,而非肝胆及心肌病变所致,与血清IBIL相比,血清LDH是诊断MA发生原位溶血的更敏感指标。
MA的幼红细胞浆内LDH水平较成熟红细胞高,当发生原位溶血后可出现血清LDH增高,表明幼红细胞、大红细胞破坏增加,进而推测红细胞生成减少及贫血程度增高,在MA患者中,血清LDH的水平与患者的红细胞数量和血红蛋白含量呈负相关,大多数患者治疗后血红蛋白升高,LDH随之降低,进一步证实其负相关。本文中患者一血清生化结果提示LDH,IBIL增高,正是由于巨幼细胞性贫血导致的,与前文的研究显示基本符合。
国外一篇名为纯合子b地中海贫血和镰状细胞/b地中海贫血患者血清中CA-15.3水平升高的文献中[5],CA153是一种可在血清中检测到的肿瘤标记物,它识别MUC-1糖蛋白的粘蛋白抗原,由上皮来源的恶性细胞,特别是乳腺癌细胞表达。
然而,MUC-1不仅由上皮细胞表达,因为各种造血细胞能够产生和表达这些抗原,该糖蛋白并非仅由上皮细胞表达。MUC-1核心蛋白的产生和表达已在正常骨髓、CD34+祖细胞和其他造血细胞以及各种血液学恶性肿瘤中得到证实。
然而,在红系细胞中发现了最显着的表达,这一发现在红细胞生成培养物中也得到了证实(Brugger等人,1999)。根据最近的一项研究,MUC-1在红细胞分化早期表达,伴随着糖蛋白a表达和红细胞生成素反应性,但随后它被下调,并在成熟红细胞中消失(Rughetti等人,2003)。
我们之前观察到,未经治疗的巨幼细胞贫血患者血清CA-15.3水平升高,这与疾病严重程度相关,但在补充维生素B12后,即在将无效的红细胞生成转化为有效的红细胞后,这种情况发生了逆转。
在这些患者中,骨髓上清液中的CA-15.3水平显着升高,这提供了骨髓可能是CA-15.3产生增加的部位的证据(Symeonidis等人,2004)。在两组受试患者中,CA-15.3水平与外周溶血和骨髓无效红细胞生成的程度密切相关。在骨髓上清液中检测到较高的CA-15.3值,表明CA-15.3产生增加的部位可能是巨幼细胞骨髓。
恶性贫血中存在与无效红细胞生成相关的极端红细胞增生,这主要影响红细胞成熟的晚期,因此,可以假设骨髓凋亡的成红细胞高MUC-1表达是检测到的血清CA-15.3水平升高的来源。或者,凋亡成红细胞释放的Lewis抗原的量增加,与粘蛋白肽核心抗原共享共同抗原表位,可能被免疫放射测定底物误识别为MUC-1,并测量为CA-15.3(Baldus等人,2002)。
在这些患者中,特别是在溶血程度高的患者中,血清CA-15.3升高的检测不一定代表隐性恶性肿瘤的标志,也不需要使用复杂的侵入性技术进行广泛的调查。然而,应仔细监测该发现,并将其与患者的溶血状态相关。
国外另外一篇名为维生素B12缺乏导致巨幼细胞性贫血患者血清CA-15.3水平升高的研究[1],对50名巨幼细胞性贫血患者进行了可能的隐性癌症筛查,发现所有患者的血清CA-15.3都意外增加,CA-15.3水平与血红蛋白以及血清LDH和B12之间的强烈相关性表明,可能会发生CA-15.3的异常产生,并与巨幼细胞性贫血的严重程度相当。
在具有其他原因的活动性溶血的患者中也观察到了类似的血清CA-15.3的意外升高(未发表的经验),发现B12缺乏导致巨幼细胞性贫血患者血清CA-15.3水平持续升高。这可能是凋亡的巨成红细胞增加CA-15.3释放的结果,似乎与临床上明显或隐匿的乳腺癌或其他来源的癌症无关.
以上文献中的研究都显示CA153增高在排除肿瘤的情况下,大部分都与巨幼红细胞贫血以及溶血相关,可惜都没有明确CA153增高的机制,需要进一步深入的研究。
总 结
肿瘤标志物的检测结果仅用于参考,疾病的诊断还需要结合相关影像学或病理学检查,肿瘤标志物检测呈阳性不一定就是肿瘤,而更多的一种提示和信号,许多良性疾病也会引起肿瘤指标的异常增高,需要引起注意。
对于临床上CA153增高的大细胞性贫血,在排除肿瘤的情况下,需要考虑是否存在血液疾病,尤其是巨幼红细胞性贫血和溶血性贫血。
专家点评
肿瘤标志物CA153是乳腺糖类蛋白质,主要是癌胚抗原,与乳腺癌的相关性比较高,但并非特异性,因此需要我们检验人员和临床工作者高度注意,CA153升高时需要与临床相结合,当与临床不符时,需要考虑其他因素,然而我们检验工作人员长期检测中遇到CA153升高时一般不会进一步探索,交给临床去判断。
但笔者作为有经验的工作人员,对检测结果和临床相结合去分析,探究原因,发现规律,并查阅文献,进行归纳总结,较好地对结果进行了分析,发现除了其他肿瘤,在大细胞性贫血时也会出现升高,这让临床对我们的结果也有了信赖,许多情况下,临床对我们检验有种误解就是我们的检验结果不稳定,而检验工作人员也给不出合理的解释,这就要求我们掌握扎实的理论基础,以及解决问题的能力,这种探索精神值得我们学习。
参考文献:
[1]Argiris S, Alexandra K, Dimitris A.Increased Serum CA-15.3 Levels in Patients with Megaloblastic Anemia due to Vitamin B12 Deficiency. Oncology 2004;67:359–367.
[2]刘净悦 ,李杰等,大细胞性贫血251例临床特征分析[J].临床内科杂志.2021,38(1):56-58
[3]王辰,王建安.内科学[M].3版.北京:人民卫生出版社,2016:783.
[4]马东升,叶芳等,血清乳酸脱氢酶检测在巨幼细胞性贫血伴原位溶血中的临床研究[J],临床医药实践, 2021,30(8),566-569
[5]A Symeonidis, A Kouraklis-Symeonidis, I Constantinidou, et al. Increased CA-15.3 levels in the serum of patients with homozygous β-thalassaemia and sickle cell/β-thalassaemia. British Journal of Haematology, 2006, 133:692-694
STTT:吉林大学刘晋宇/高洪文/中国医科大学高兴华合作揭示黑色素瘤中PBX1作为致癌基因影响肿瘤发展的调控机制
![]() 0
2023-01-08
点击查看
0
2023-01-08
点击查看

自从用了这种疗法,不再担心肿瘤局部复发!
![]() 0
2023-01-10
点击查看
0
2023-01-10
点击查看
冯新华团队揭示HERC3促进YAP/TAZ蛋白稳定和肿瘤发生发展作用及分子机制
![]() 0
2023-01-10
点击查看
0
2023-01-10
点击查看

ALE.F02靶向Claudin-1的单次剂量递增1期研究取得积极成果
![]() 0
2023-01-14
点击查看
0
2023-01-14
点击查看

新发现!用好常见降压药,或可降低结直肠癌发病风险
![]() 0
2023-01-12
点击查看
0
2023-01-12
点击查看
Advanced Science:初波/柴人杰/尹成骞团队揭示色氨酸代谢调控肿瘤细胞铁死亡可塑性
![]() 0
2023-01-16
点击查看
0
2023-01-16
点击查看
