过去几年中,通过
干细胞三维培养物来生成“迷你人脑”组织的实验方法已经允许科学家们对大脑发育这一生命奥秘进一步深度分析:了解进化过程中其发育如何发生变化,及其研究大脑是如何受疾病影响的。然而,一大批问题目前尚不明了,诸如这些“脑体(brain organoids)”组织中会准确出现哪些细胞类型?“脑体”之间的个体化差异有多大?以及成熟神经元网络是否能够在这些组织中形成和起作用?使用精巧复杂的技术组合,近期发表在《自然》杂志上的两篇论文描述了解决这些问题的关键性步骤。
大体上,通过
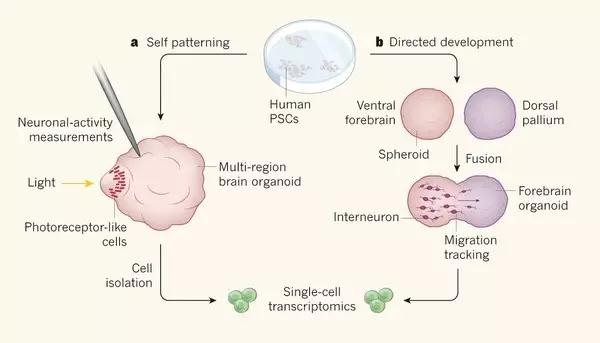
干细胞来长成“脑体”组织有两种策略:在第一个策略中,通过引导多能干细胞(pluripotent stem cells,PSCs可以在体内产生任何细胞类型)形成被称为神经上皮的干细胞层,其可以产生神经元。神经上皮进一步发育可导致多个脑区的产生。这种自我构建的策略提供针对了解大脑区域如何自我组织交互的潜力。然而,“脑体”组织个体之间以及分批生长的批次之间通常存在较大差异。
▲通过干细胞来长成“脑体”组织的两种策略(图片来源:《自然》)
另外一种可替代化的策略则是使用信号分子来控制神经上皮的模式形成,例如前脑或下丘脑某一特定区域的形成。这种技术可能会增加实验的可重复性,但是研究人员尚未完全发现和了解被用来指导控制每个大脑区域部分的细胞信号通路。 此外,科学家们也不清楚某些大脑区域是否可以在没有相邻结构的情况下形成。
第一篇论文中,来自哈佛大学(Harvard University)的研究人员详细研究了成熟“脑体”组织的组成和功能。他们修改了一个“自我构建”的试验方案,以减少由于缺氧而引起的细胞死亡。使用该这种修饰后方法生长的“脑体”逐渐成熟9个月以上,于是更加有可能研究在相当于人类妊娠时间阶段的神经元发育过程。
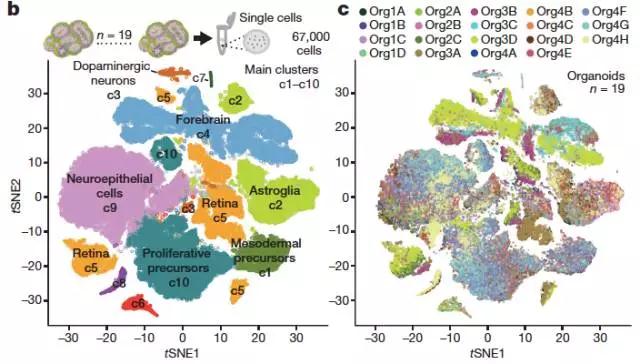
▲“自我构建”试验方案形成复杂多样化的“脑体”组织(图片来源:《自然》)
研究人员分析了来自3或6个月龄“脑体”组织的8万多个细胞的基因表达谱,这是迄今为止针对“脑体”最全面的单细胞分析研究。这些数据显示来自不同大脑区域具有不同的细胞群体。研究人员着眼于视网膜细胞类型,他们发现该体外组织中几乎包含人体内组织中被发现的每一种细胞类型;他们还发现神经元随着时间推移而成熟,开始表达介导与其他神经元突触连接的基因。那么,这些神经元成熟到底有多成熟呢?组织连续切片的电子显微镜图像显示,8个月大的“脑体”神经突触密度大概相当于胚胎期的人脑皮层。单个神经元突起(树突)经常产生多个突触,表明在这个阶段已经形成了复杂的神经网络。最后,研究作者表明,神经元亚群在暴露于光照后降低了放电速率。这一结果表明:“脑体”含有感光视网膜神经元(感光细胞);“脑体”可用于研究生理刺激是如何调节神经元网络。
值得注意的是,哈佛大学Quadrato博士及其同事发现组织间批次之间的细胞组成差异很大。这突出了需要控制“脑体”组织工程化,以便在研究疾病机制时提高实验可重复性。在第二项研究中,来自斯坦福大学医学院(Stanford University School of Medicine)的研究人员向这个方向迈进了一大步。
研究作者们使用“受控构建”化方案来产生一种球体的三维结构,其类似于两个前脑区域:腹侧前脑(ventral forebrain),其产生被称为中间神经元的抑制性神经元;和包含兴奋性神经元的背侧大脑(dorsal pallium)。单细胞转录组分析显示这些球状细胞与人胚胎期大脑相对应的区域非常相似。
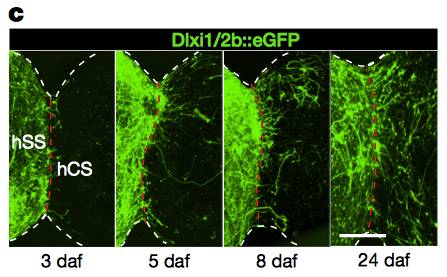
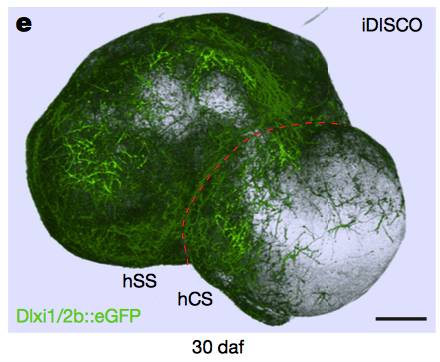
接下来,斯坦福大学的Birey博士和同事将不同类型的脑球体放在彼此旁边,并允许它们融合几天后以形成前脑样( forebrain-like )组织。来自腹侧球体的中间神经元迁移到背部区域,这一过程非常类似于这些中间神经元在体内所采取的迁移途径。迁移后,中间神经元趋于成熟。作者们发现中间神经元迁移后,融合组织中的神经元发生了更强烈的神经电生理活动。
▲中间神经元在“脑球体”组织中的迁移(图片来源:《自然》)
研究人员还使用活细胞成像来跟踪单个中间神经元,将其行为与人和小鼠脑中的等效细胞行为进行比较。某些人类特定的细胞迁移活动在融合的脑球体中被准确重现,呈现出研究介导迁移运动基因功能的可能性。事实上,接下来Birey博士等使用了他们的脑球体系统来研究神经发育障碍Timothy综合征。这一疾病与调节中间神经元迁移的蛋白质突变密切相关。首先,作者通过诱导来自Timothy综合征患者成熟分化细胞来产生多能PSCs,然后他们在此基础上产生融合的前脑组织。与正常对照组相比较,患者来源的中间神经元展示了较低效率的细胞迁移。
这两项研究都揭示了高通量单细胞转录组学技术来量化脑组织细胞型多样性的能力。这些方法对于研究疾病期间细胞组成和基因表达网络如何失去调控具有价值。许多工作表明,从诱导的PSCs工程改造的脑组织可以准确地模拟神经元祖细胞的行为。这两项新的研究有利展示了通过改善脑组织技术来研究大脑区域之间的相互作用,以及成熟神经元在协调网络中的作用方式。我们非常期待从这些“迷你脑”中探索海量科学信息!
来源:药明康德
版权声明:
本网站所有注明“来源:梅斯医学”或“来源:MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有,非经授权,任何媒体、网站或个人不得转载,授权转载时须注明“来源:梅斯医学”。本网所有转载文章系出于传递更多信息之目的,且明确注明来源和作者,不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。同时转载内容不代表本站立场。
在此留言