【研究背景】
放射治疗是癌症的主要治疗方法之一,然而部分癌细胞会产生适应性抵抗能力,导致治疗失效。增强DNA复制压力是克服癌症放疗抵抗的一个有效途径。放疗诱导的复制压力表现在模板链损伤后阻碍复制叉的进展,导致复制过程趋渐停滞。其中,复制叉是DNA双螺旋分离并进行复制的结构区域,其沿着模板链合成双链并分离为两条子代DNA;当模板链受到放疗损伤(如单链断裂)时,复制叉可能会在受损处碰撞形成双链断裂并坍塌。目前,为增强复制压力、提高放疗疗效已经开发了一些检查点抑制剂,例如ATR抑制剂和Wee1抑制剂。这些检查点抑制剂通过阻止DNA修复和扰乱细胞周期控制来增强复制压力,在克服放射治疗抵抗方面表现出潜力。然而,它们面临一个重要限制,即缺乏对癌细胞的选择性,抑制DNA修复途径同样会减弱正常细胞对放疗诱导毒性的抵抗力。因此,仍然需要开发能够更有选择性的方案,增强癌细胞的复制压力。
针对上述问题,浙江大学李方园教授团队报道了一种癌症选择性复制压力纳米放大器 (RSNA),通过促进癌细胞中的复制压力以克服放疗抗性。RSNA 由载有化疗药物阿霉素 (DOX) 的催化性FePt纳米颗粒组成。RSNA利用其过氧化氢酶 (CAT) 样催化活性将 ROS 转化为氧气,增强放疗对 DNA 的损伤作用,同时为复制叉引入更多障碍。其次,放疗过程中产生的活性氧(ROS)作为信使分子,可以通过过氧化物还原蛋白 2 (PRDX2) 降低复制叉移动速度。RSNA在放疗后消耗细胞质中ROS,拦截PRDX2所需的“减速信号”,促使复制叉高速进运行,从而增加复制叉坍塌和双链DNA断裂的概率。此外, RSNA通过DOX的化疗作用增加了S期细胞的比例,使更多细胞受到放疗引起的复制压力的影响。这些效应共同作用,最大程度地增强了放疗后癌细胞中的复制压力,有效克服了体外癌细胞和原位直肠癌小鼠模型中的放疗抵抗。

RSNA选择性放大癌细胞复制压力的方案
【研究工作简介】
作者将结直肠癌细胞(CT26)与小鼠原代肠细胞(PEC)比较,如图1所示,观察到RSNA在细胞内有效地清除癌细胞中的ROS、诱导CT26细胞的氧气生成,并以此增强了CT26细胞中放疗引起的急性DNA损伤效应。重要的是,通过重塑癌细胞中的氧化应激和乏氧环境来增强DNA损伤的方案具备癌细胞选择性。与游离DOX相比,RSNA没有进一步增加PEC细胞中γH2AX蛋白的水平,这表明RSNA主要增强了癌细胞的DNA损伤反应。

图1. RSNA选择性地增强放疗引起的癌细胞DNA损害
复制叉的速度受细胞的氧化还原状态的影响并导致了复制压力。因此,作者研究了RSNA对癌细胞放疗后复制叉速度及其复制压力产生的影响。通过单分子DNA纤维分析,放疗后CT26癌细胞的复制叉速率显著下降,但在RSNA处理后基本恢复到放疗前的水平(图2a)。这种复制叉速率的恢复增强了复制叉的不对称性,表明促进了复制叉与模板DNA损伤点的碰撞并加剧了复制压力(图2b)。
PRDX2是一种ROS响应的复制体复合物的成分,在氧化应激加剧的条件下,PRDX2可以与复制叉分离以降低复制速。如图2c、d,放疗后,染色质结合的PRDX2水平下降,而RSNA的ROS清除拦截了PRDX2的分离。因此,进一步促进了放疗后复制相关DNA损伤的形成(图2e,f),并提高了DNA双链断裂的水平(图2g)。由于只有进行活性DNA复制的S期细胞才容易受到复制压力的影响,进一步分析了RSNA处理后的细胞周期。RSNA的DOX导致S期细胞的比例增加了1.5倍(图2h)。这些发现表明,RSNA可以通过增加模板DNA损伤、诱导复制叉高速运行、增加S期细胞的数量的协同作用,有效地促进癌细胞的复制叉坍塌以加剧复制压力。
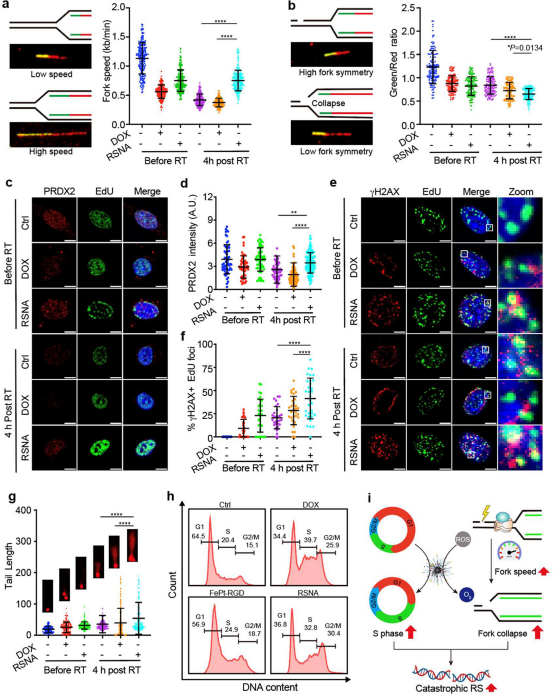
图2. RSNA加剧癌细胞中的复制压力的机制
最后,建立原位直肠癌的小鼠模型,测试RSNA在体内克服放射抵抗的能力(图3)。缺氧诱导因子1亚基α(HIF-1α)的表达减少显示RSNA缓解了肿瘤缺氧,病理切片显示RSNA选择性地增强了放疗对肿瘤组织的DNA损伤作用(直肠上皮等正常组织五明显损伤)。与其他对照组相比,RSNA和放疗的组合在抑制肿瘤生长和诱导肿瘤细胞死亡方面具有最强的疗效。此外,RSNA没有诱发明显的全身毒性,并且由于肿瘤靶向能力及其ROS清除活性而降低了DOX的毒性。
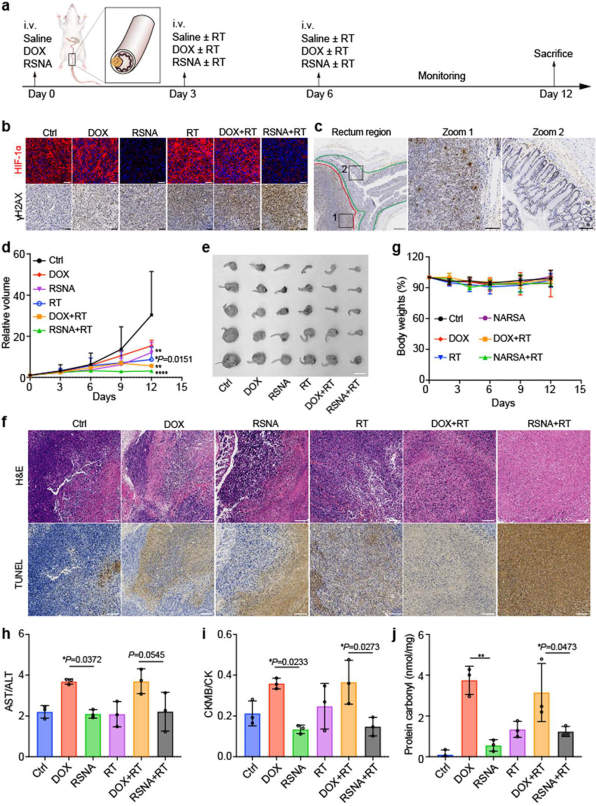
图3. RSNA克服原位直肠癌小鼠模型的放疗抵抗
【工作的亮点、新颖性和意义】
复制压力在包括放疗在内的各种抗癌治疗的疗效方面发挥着关键作用。在这项研究中展示了纳米制剂放大癌细胞复制压力的潜力,从而显着改善癌细胞的放射敏感性。RSNA 的催化和化疗作用的整合协同促进放疗后的复制叉坍塌,以显著放大复制压力从而克服癌细胞的放疗抵抗。
放疗后清除ROS以增强放疗敏感性的概念似乎违反直觉。为了全面了解这种现象,本课题深入研究放疗如何诱导DNA损伤的基本过程,该过程发生在两个不同的阶段:
1)初始阶段涉及放疗产生ROS并直接损伤DNA,由于ROS 的持续时间短且扩散范围有限,导致氧化损伤主要发生在其产生附近。因此,只有细胞核内产生的 ROS 才能显着引起 DNA 损伤,考虑到RSNA位于细胞质中,它不会干扰细胞核内ROS的爆发,从而保留了放疗过程中的急性DNA损伤作用。相反,RSNA在细胞质中产生氧气扩散到细胞核中,最终增强放疗导致的急性 DNA 损伤作用。
2)第二阶段在放疗后长期发生,此时,放疗引起的代谢扰动导致的 ROS 水平升高具有双重影响。一方面,ROS导致碱基氧化,放大复制压力;另一方面,ROS 介导的复制叉减速将缓解复制压力。通过有效清除代谢ROS加速复制叉进展、并通过DOX来补偿复制压力源的损失,可有效地将单链DNA损伤转变为DNA双链断裂。因此,RSNA的ROS清除活性意外地增强了癌细胞的放射敏感性。
此外,DOX还可能通过充当 ROS 诱导的触发器来刺激细胞内 ROS 的产生,为FePt催化纳米颗粒提供反应物,从而通过催化机制强化放疗对 DNA 的损伤影响。DOX 和催化 FePt 纳米颗粒核心之间复杂的相互作用,在不同的亚细胞域内发挥作用,为开发放大癌细胞复制应激的功能性纳米材料提供了有效的策略。
【论文信息】
Hongwei Liao‡, Shengfei Yang‡, Zeyu Liang, Lin Xiao, Shangzhi Xie, Peihua Lin, Fan Xia, ChunYan Fang, Qian Chen, Daishun Ling*, Fangyuan Li*, A Cancer Cell Selective Replication Stress Nano Amplifier Promotes Replication Fork Catastrophe to Overcome Radioresistance, ACS Nano, 2023
DOI:10.1021/acsnano.3c06774