1型神经纤维瘤病(NF1)是由NF1基因中的一个自发突变或遗传突变引起,在婴儿中的发病率大约为三千分之一。NF1患者可能会伴有脊柱扭曲和弯曲、高血压、癫痫等并发症,也会增加患有其他癌症的风险,包括恶性脑和外周神经鞘肿瘤及白血病。该病症状在儿童早期开始,严重程度变化很大,可使预期寿命减少多达15年。2020年4月10日,美国FDA批准了英国阿斯利康公司开发的MEK1/2抑制剂司美替尼(Selumetinib)上市,适应症为2岁及以上儿童的1型神经纤维瘤病(NF1)且有症状的、无法手术的丛状神经纤维瘤(PN)患者。2020年10月,由博鳌超级医院提交的中国首例“司美替尼(Selumetinib)进口临床急需药品”申请在海南药监局获批。
MEK与肿瘤
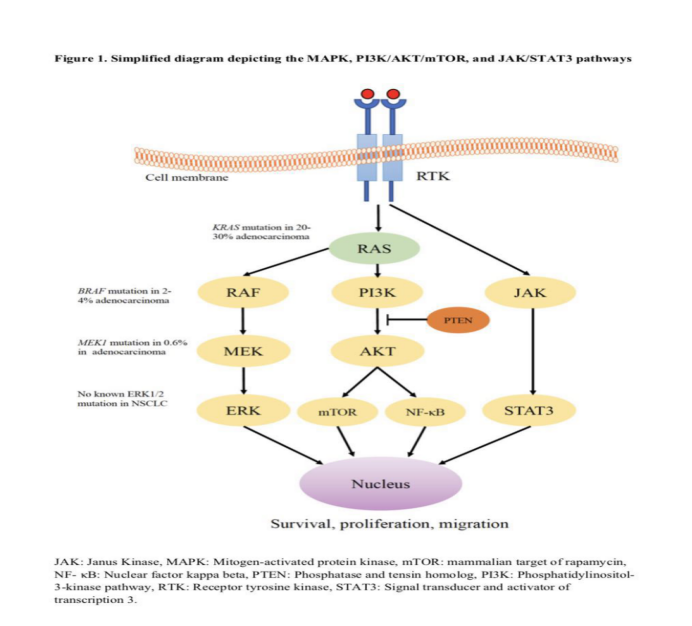
司美替尼是一种可口服的、选择性的、非竞争性的ATP活性的MEK1/2抑制剂,MEK这个靶点很多患者朋友从未听过,但其所在的MAPK通路是非常有名气的,参与了包括非小细胞肺癌在内的多种癌症的肿瘤发生。该通路由四种重要的激酶组成,形成上下游信号传递通路,分别是RAS—RAF—MEK---ERK。正常生理功能是可以促进细胞的生长、增殖、分化和迁移。,但当该通路上基因发生突变而活化时,该通路会被异常持续激活,导致细胞增殖不受限,而形成肿瘤细胞,而我们各癌种中常见的KRAS、BRAF的突变就基于该通路。而MEK抑制剂可以通过阻断下游通路的方式阻断上游基因变异引起的异常活化,从而发挥抗肿瘤作用。KRAS在肺腺癌的发生率为20%-30%,BRAF在肺腺癌的发生率为2%-4%,MEK1在肺腺癌的发生率为0.6%。
MEK抑制剂司美替尼
司美替尼是首个获得FDA批准治疗1型神经纤维瘤的靶向药物!是基于基于开放标签、多中心的单臂研究SPRINT试验(NCT01362803),参与该试验的NF1儿童患者携带无法通过手术治疗的丛状神经纤维瘤(PN)。试验结果显示,Selumetinib的治疗使患者的总缓解率(ORR)达到 66%,所有患者均达到部分缓解,且有 82% 的患者持续缓解至少12个月。
该研究最新结果于2020年4月9日发表在《N Engl J Med》上。
该试验共纳入50例临床诊断为1型神经纤维瘤(NF1),存在不能手术的丛状神经纤维瘤(PN)且可吞咽完整胶囊的2-18岁儿童患者。接受推荐剂量(每天两次口服selumetinib 25mg/m2,直到疾病进展或出现不可接受的不良反应),主要研究终点NCI评估的总体缓解率(ORR),定义为在3~6个月的后续MRI检查中经MRI确认肿瘤体积缩小≥20%的患者所占的百分比。
研究结果显示,在50名患儿中,共计37名(74%;95% CI,60~85)达到了部分缓解,35名(70%)达到了经证实的部分缓解,28名(56%)达到了持久缓解。本研究未到达中位持续缓解时间和中位无进展生存期。截至治疗开始3年后,无进展生存率为 84%。

图1.3年随访,Selumetinib和自然史相比,
PFS分别为84%和15%
最常见的不良反应(占患者的40%以上)有呕吐、皮疹、腹痛、腹泻、恶心、皮肤干燥、疲劳、肌肉骨骼疼痛、发烧、痤疮、口腔炎、头痛、甲沟炎和瘙痒。严重不良反应方面,Selumetinib可引起心肌病,导致心力衰竭,表现为射血分数的下降及肌酸酐磷酸激酶升高;还可导致眼毒性,表现为视网膜静脉阻塞、视网膜色素上皮脱离、视力障碍等。
不用出境就可以和国外同步使用最新抗癌新药
随着疫情的开放,患者的用药可及性大大增加,不管是赴港还是去海南博鳌都多了治疗可选性,文中提到的司美替尼已完美落地海南博鳌,并且根据进口药品带离管理暂行办法,患者经过审批,可将仅供自用的口服进口药品带离先行区,这也大大增加了患者用药的便捷性,降低了患者及家属用药衣食住行等辅助成本。