01 什么是免疫组化?
免疫组化即免疫组织化学(Immunohistochemistry,IHC),是在组织切片或细胞涂片上利用抗体检测抗原并将其可视化的技术[1]。换句话说,就是在组织切片或细胞涂片上检测特定蛋白质的方法,这种技术利用抗体的高度选择性结合来确定组织中特定抗原的位置。通过做免疫组化可以确定组织中是否存在某种特定的蛋白质,并能够了解该蛋白质在组织中的位置和相对数量。这对于研究疾病的诊断、病理生理学和药物研发等方面具有广泛的应用。
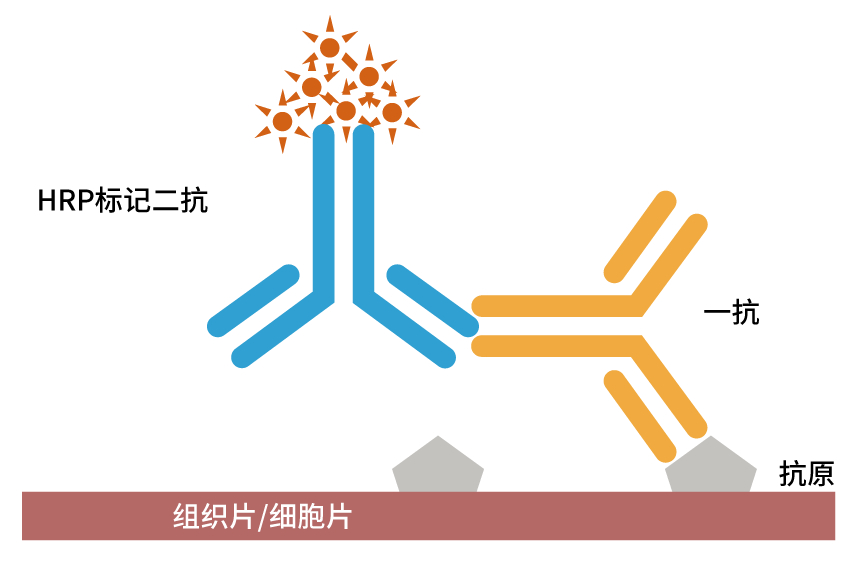
图1:免疫组化检测原理
(SP法)

图2:组织样本
02 为什么有的患者需要做免疫组化?
"病理乃医学之本",病理诊断是绝大部分疾病临床诊疗的“金标准”,尤其对肿瘤疾病的诊断,更是一封“判决书”。一般情况下,对于常见的肿瘤类型,病理医生可以通过HE染色观察组织/细胞形态学变化完成病理诊断。
但是,许多肿瘤类型在组织学上非常相似,而它们的治疗和预后可能有很大的不同;并且一种肿瘤可能有很多不同的亚型,这些亚型可能在生物学行为和治疗反应方面有所不同。因此,在对此类肿瘤进行诊断的过程中,病理医生仅靠HE染色切片很难作出准确的判断,需要借助免疫组化技术来进一步排除相似的病变,来明确疾病的类型[2]。
03 免疫组化有什么作用?
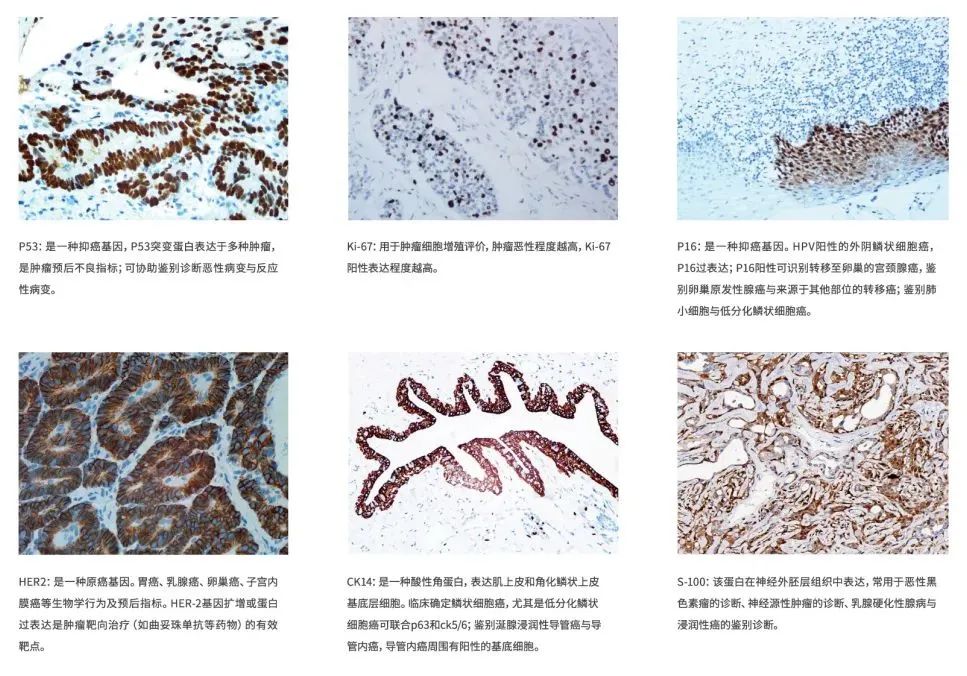
从上世纪50年代免疫组化技术的建立以来,不断改良、创新、发展,如今,免疫组化技术也进入了标准化、规范化及质量控制阶段,上百种的肿瘤细胞特异性表达抗体的发现和应用,使我们对肿瘤细胞的认识与诊断有了更加客观性的依据。在临床应用中,免疫组化技术能够帮助病理医生完成肿瘤良恶性的判断、确定肿瘤分期、细胞属性的判定、确定来源不明的肿瘤转移灶的原发部位、对“未分化”恶性肿瘤进行分类、进一步分类不同器官与组织形态学重叠的肿瘤、及时准确地发现微小转移灶、指导临床治疗方案及伴随诊断等。
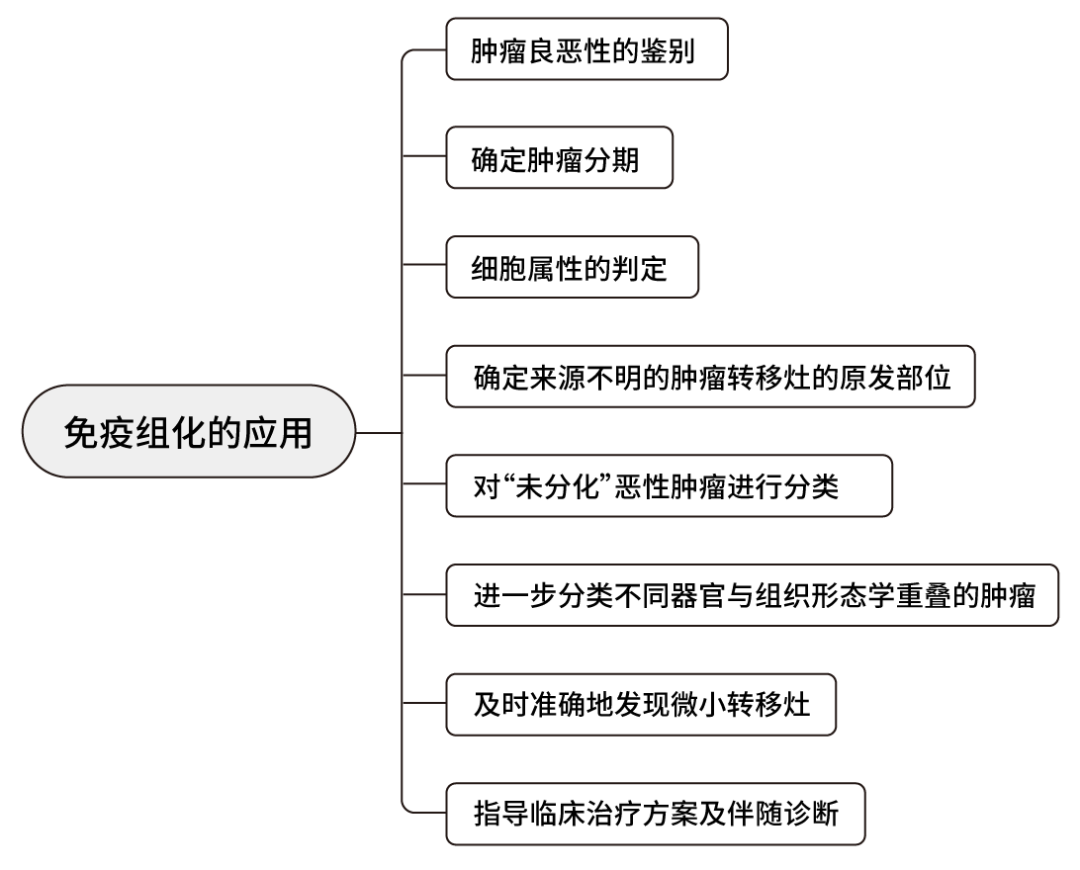
图2:免疫组化检测的应用
01 肿瘤良恶性的鉴别
肿瘤组织形态千变万化,免疫组化可以给细胞做特殊标记,明确肿瘤细胞的分型、分类。例如,通过免疫组化观察肿瘤组织中TTF-1、Napsin A、CK5/6和p63(p40)蛋白是否表达可鉴别非小细胞肺癌中的腺癌和鳞癌[3]。
02 确定肿瘤分期
肿瘤分期是判断预后的重要指标,与是否浸润、有无淋巴管或血管侵袭密切相关。这些在常规组织切片中有时很难判断,而免疫组化染色后可以比较清楚地观察到。例如对于宫颈上皮内瘤变CIN2级病变诊断的重复性较差,不同病理医生对于CIN2级病变的诊断一致性仅为43%,在病理活检中见到这类病变可以加做p16、Ki67免疫组化染色来明确高级别病变还是低级别病变[4]。从临床治疗的角度明确患者是否应该进行锥切手术还是密切随访。
03 细胞属性的判定
通过特定抗体标记出细胞内相应的抗原成分,从而判定细胞的属性,确定肿瘤的来源。如角蛋白抗体(CK20)在胃肠道癌、胆管癌、胰腺癌中阳性,而在肺癌、乳腺癌、肾癌中阴性[5]。
04 确定来源不明的肿瘤转移灶的原发部位
转移灶与原发灶通常具有共同的抗原表达性,利用多种标记物对来源不明的转移灶进行标记,进而推断转移来源[6]。
05 对“未分化”恶性肿瘤进行分类
未分化恶性肿瘤在HE切片上由于肿瘤的“未分化”而缺少肿瘤细胞的起源特征,因此难以分类。这类肿瘤通常需要用一组抗体才能明确诊断[7]。
06 进一步分类不同器官与组织形态学重叠的肿瘤
由于形态学交叉重叠的特征,仅凭组织学基础对肿瘤进行分类很困难。例如在胃肠道梭形细胞肿瘤中,胃肠道间质瘤、平滑肌瘤和神经鞘瘤在形态上鉴别困难,治疗上也完全不同,但用免疫组化就可以将它们区分开来。胃肠道间质瘤表达CD117和DOG1,而平滑肌瘤和神经鞘瘤一般不表达[8]。
07 及时准确地发现微小转移灶
在常规组织切片中,辨别单个或几个转移性肿瘤细胞比较困难,究竟是淋巴结内窦性组织细胞增生,还是某些癌的早期转移有时很难下定论,病理医生需要做免疫组化明确诊断[9]。
08 指导临床治疗方案及伴随诊断
一些生物标记物可以帮助临床医生确定疾病治疗方案,如 ER(雌激素受体),PR(孕激素受体)能够确认患者能否在内分泌治疗中获益以及预测预后,阳性应考虑内分泌治疗,阴性提示肿瘤更具有侵袭性,对内分泌治疗相对不敏感。而HER2(人表皮生长因子受体2)则能够确认患者是否适合HER2靶向治疗及预测预后,针对HER2阳性的乳腺癌患者可进行靶向治疗。同时HER2阳性也提示肿瘤呈侵袭性生长,预后差[10]。
04 案例展示
案例1:免疫组化应用于去分化脂肪肉瘤的鉴别诊断
去分化脂肪肉瘤大多数发生于腹膜后、腹腔、盆腔等处,大部分患者死于无法控制的局部复发。从定义来说,去分化脂肪肉瘤是指从高分化脂肪肉瘤突然过渡到非脂肪性的肉瘤,非脂肪性成分可有多种形态,如细胞形态为梭形、上皮样、多形性,间质黏液样程度不一,甚至约10%的病例出现异源性成分。如未取到高分化脂肪肉瘤成分,则并无独特形态学特点。非脂肪性成分可不同程度的表达SMA、desmin,因此可与平滑肌肉瘤混淆。
但是,去分化脂肪肉瘤(和高分化脂肪肉瘤)具有独特的分子遗传学改变,包括致癌基因MDM2、CDK4高水平扩增。MDM2对于去分化脂肪肉瘤来说,是一个可明确诊断的标志物。通过免疫组化检出MDM2过表达或FISH检测MDM2扩增均可用于鉴别诊断。免疫组化检测CDK4和MDM2的特异性要强于仅检测MDM2。
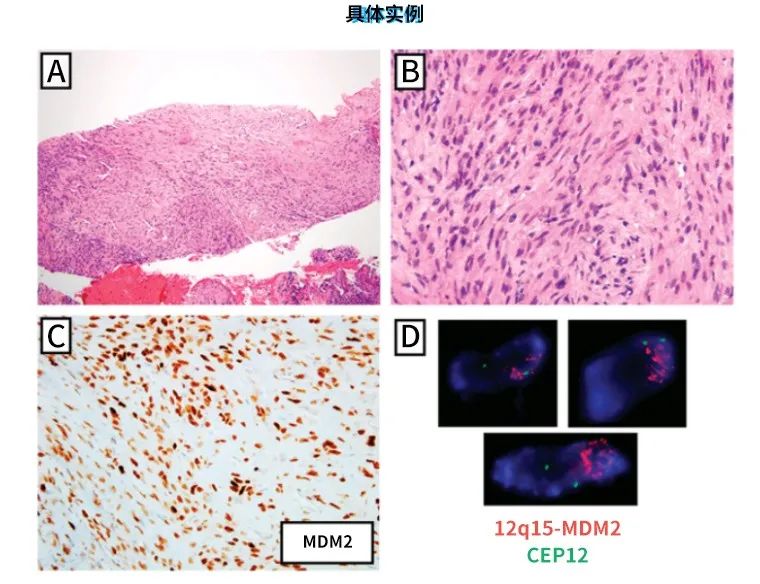
图3.去分化脂肪肉瘤[11]。本例为63岁男性,腹膜后巨大肿物,粗针穿刺活检。镜下见细胞密度不一的梭形细胞肿瘤。瘤细胞具有轻度异型性,可见核分裂,呈束状排列。组织学表现并无特异性。免疫组化MDM2检测为细胞核强阳性;细针穿刺标本制备细胞学涂片,行FISH检测,针对染色体12q15区MDM2基因的红色探针数量多,而针对12号染色体着丝粒的绿色探针为正常的2个,表明MDM2基因有高水平扩增。诊断为去分化脂肪肉瘤。
案例2:免疫组化应用于原位间皮瘤的鉴别诊断
良性及浸润前间皮肿瘤包含腺瘤样瘤、高分化乳头状间皮肿瘤及原位间皮瘤。原位间皮瘤已成为一种精确定义的临床病理实体,仅形态学上的非典型增生,不能区分原位间皮瘤与反应性间皮增生,其诊断需要通过免疫组织化学证明BAP1或MTAP的缺失[12]。
对于临床表现为不明原因的难治性胸水患者,如影像学及胸腔镜未发现明确病变,免疫组织化学检测BAP1表达缺失和(或)MTAP表达缺失,有助于提高积液样本和有限组织样本的诊断敏感性,鉴别诊断原位间皮瘤。
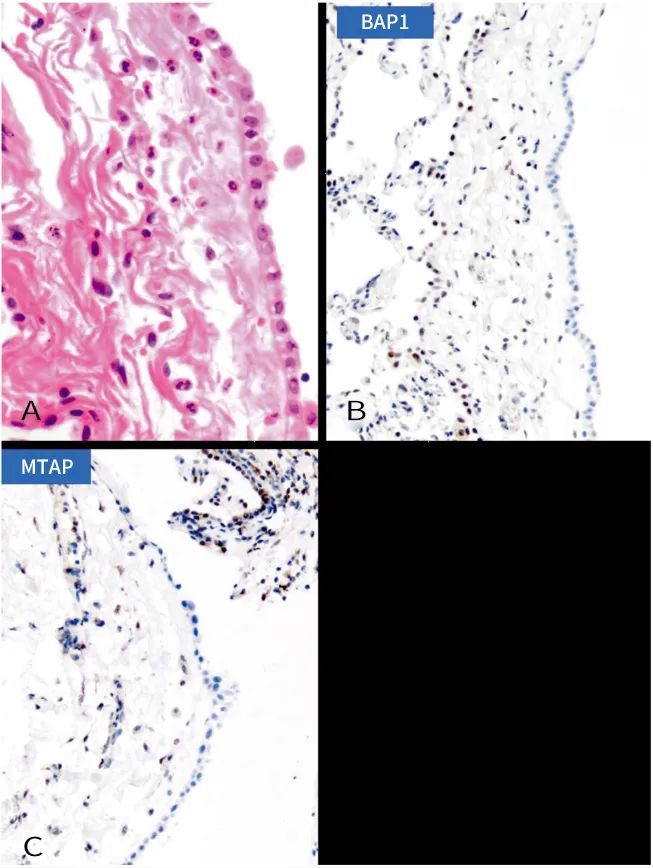
图4. 原位间皮瘤[13]。(A)单层扁平的间皮细胞(H&E,×40)(B)肿瘤间皮细胞中BAP1缺失,而间质和炎症细胞中完整(IHC,×20)(C)间皮细胞中MTAP IHC缺失作为CDKN2A纯合缺失的替代标记(IHC、×20)
参考文献
1. 《免疫组织化学检测技术共识》编写组.免疫组织化学检测技术共识[J].中华病理学杂志,2019,(2):87-91.
2. 吴丹桔.免疫组化技术在肿瘤病理诊断中的应用[J].现代诊断与治疗, 2013, 24(15):3428-3429.
3. 叶绿,梅傲男,尹黎舟,等.肺癌活检标本的免疫组化检测在非小细胞肺癌鉴别诊断中应用价值分析[J].医药前沿, 2019, 9(1):2.
4. 高琨,邱明,李宁,等.P16INK4a和Ki-67在宫颈癌前病变诊断中的意义[J].中国肿瘤临床与康复, 2010(4):3.DOI:CNKI:SUN:ZGZK.0.2010-04-009.
5. 何建芳,韩安家 -,吴秋良.实用免疫组化病理诊断[M].科学出版社,2018.
6. 周晓军,陈旭东.免疫组化在来源不明转移性腺癌鉴别诊断中应用[J].临床与实验病理学杂志, 2005.DOI:CNKI:SUN:LSBL.0.2005-05-000.
7. 姚根有赵仲生.未分化癌与恶性淋巴瘤鉴别诊断的免疫组化研究[J].实用癌症杂志, 1993, 008(002):78-79.
8. 郑铭,江淑萍,何毅辉,等.胃肠道间质瘤组织中DOG1与CD117、CD34的表达及意义[J].中国老年学杂志, 2012, 32(6):3.DOI:10.3969/j.issn.1005-9202.2012.06.024.
9. 臧静,赵增顺,刘福坤,黎介寿.胃癌患者骨髓微小转移灶的免疫组化检测[J].实用癌症杂志, 1994, 9(4):2.DOI:CNKI:SUN:SYAZ.0.1994-04-004.
10. 《中国临床肿瘤学会(CSCO)乳腺癌诊疗指南2023版》
11. Hornick JL. Limited biopsies of soft tissue tumors: the contemporary role of immunohistochemistry and molecular diagnostics. Mod Pathol. 2019 Jan;32(Suppl 1):27-37. doi: 10.1038/s41379-018-0139-y. Epub 2019 Jan 2. PMID: 30600320.
12. Feng AN, Meng FQ, Zhang S. [Interpretation of the 5th WHO classification of thoracic tumors: tumors of the pleura and pericardium]. Zhonghua Bing Li Xue Za Zhi. 2022 May 8;51(5):393-399. Chinese. doi: 10.3760/cma.j.cn112151-20220111-00022. PMID: 35511633.
13. Dacic S. Pleural mesothelioma classification-update and challenges. Mod Pathol. 2022 Jan;35(Suppl 1):51-56. doi: 10.1038/s41379-021-00895-7. Epub 2021 Aug 31. PMID: 34465883.