近日,美国食品和药品监督管理局宣布其抗菌药物咨询委员会 (AMDAC) 即将召开会议,以讨论默克和Ridgeback对molnupiravir的紧急使用授权 (EUA) 的申请,molnupiravir是一种用于治疗COVID-19 的研究性抗病毒药物。
11月30日,咨询委员会将召开会议,讨论支持使用molnupiravir治疗COVID-19轻中度患者的决议。
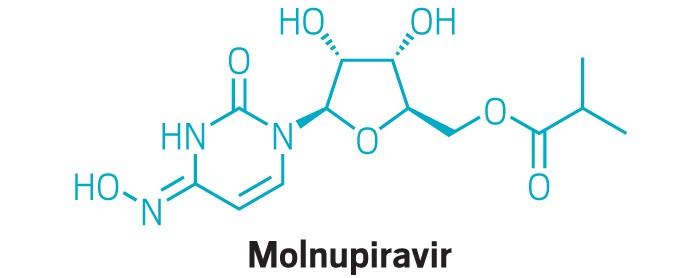
FDA 的药物评价和研究中心,医学博士 Patrizia Cavazzoni 说:“ FDA 正在评估默克和 Ridgeback 在其紧急使用授权请求中提交的安全性和有效性数据,molnupiravir是一种针对新诊断出的COVID-19 感染的高危人群的新型口服治疗药物。我们认为,在这种情况下,与 FDA 咨询委员会对这些数据进行公开讨论将有助于确保清楚了解 FDA 正在评估的科学数据和信息,以决定是否批准该药物的EUA”。
根据 FDA 的判断,该机构可以召集一个咨询委员会,就各种复杂的科学、技术和政策问题征求独立的外部专家的建议。FDA 并不总是召集与 EUA 审查相关的咨询委员会会议,但在某些情况下可能会召开咨询委员会会议,因为与咨询委员会的讨论将有助于为机构决策提供信息。
会议是在公司提交 EUA 请求后尽快安排的。该时间表允许 FDA 在会议之前彻底评估 EUA 请求中提交的数据和信息。在会议期间,委员会将听取公司关于抗病毒药物数据的介绍。在此举行公开听证会期间,公众将有机会发表意见。
FDA 打算在不迟于会议前两个工作日向公众提供 AMDAC 会议的背景材料,包括会议议程和委员会名册。
原始出处:
https://www.firstwordpharma.com/node/1871334?tsid=4
NEJM:以色列BNT162b2疫苗加强对Covid-19预防效果
![]() 0
2021-10-09
点击查看
0
2021-10-09
点击查看
JNNP:COVID-19感染与焦虑和抑郁症状存在关系
![]() 0
2021-10-11
点击查看
0
2021-10-11
点击查看
MCP:COVID-19康复期的男性献血者HLA抗体并没有增加
![]() 0
2021-10-12
点击查看
0
2021-10-12
点击查看

Radiology:COVID-19感染1年后胸部CT检查时残留的肺病变
![]() 0
2021-10-12
点击查看
0
2021-10-12
点击查看

J Evid Based Dent Pract:洗必泰和聚维酮碘漱口水可有效杀灭唾液中SARS-CoV-2
![]() 0
2021-10-14
点击查看
0
2021-10-14
点击查看

临床前数据证明, NLS-4(Lauflumide)或可治疗COVID-19相关的慢性疲劳
![]() 0
2021-10-17
点击查看
0
2021-10-17
点击查看