[摘要] 背景与目的:对于局部高危软组织肉瘤,单纯手术治疗常常不能获得满意效果。本研究旨在评估术前放疗联合手术用于治疗局部高危软组织肉瘤患者的近期疗效和安全性。方法:回顾性分析2021年2月—2022年6月在复旦大学附属肿瘤医院接受术前放疗的连续性患者的临床资料,包括临床特征、放疗方案、影像学资料及病理学资料等。放疗的靶区勾画采用图像融合技术,将磁共振成像(magnetic resonance imaging,MRI)图像融合至模拟定位计算机体层成像(computed tomography,CT)图像上,勾画靶区时逐层参考。所有患者均接受调强适形放疗(intensity-modulated radiotherapy,IMRT)技术制订的放疗计划。计数资料采用百分数表示。分析影像学应答(完全缓解、部分缓解、疾病稳定、疾病进展、客观缓解及疾病控制)比例、病理学应答[接近病理学完全缓解(near-pathologic complete response,near-pCR),定义 为≥90%的无活性肿瘤细胞]比例及毒性反应(急性皮肤损伤和术后120 d内伤口并发症)比例。结果:共41例患者在术前接受了放疗,其中33例患者符合纳入标准:31例可进行影像学评估,28例可进行病理学评估。患者的中位年龄为53岁,30例(90.9%)患者的肿瘤组织学分级为3级。影像学分析提示,6例(19.4%)患者获得部分缓解,1例患者出现疾病进展,无人获得完全缓解,客观缓解率为19.4%,疾病控制率为96.8%。病理学分析提示,8例(28.6%)患者near-pCR;排除既往接受过化疗的患者,near-pCR率为34.8%(8/23)。33.3%(11/33)和3.0%(1/33)患者出现1和2级皮肤损伤,未发生3和4级皮肤损伤。1例(3.3%)患者出现术后120 d内的严重伤口并发症。结论:利用MRI图像融合技术和IMRT技术的术前放疗对于局部高危软组织肉瘤患者,近期疗效良好,急性毒性反应可接受。
[关键词] 软组织肉瘤;术前放疗;磁共振成像;调强适形放疗;客观缓解率;伤口并发症
[Abstract] Background and purpose: Surgery alone is not enough to get satisfied outcome for locally high-risk soft tissue sarcoma (STS). We retrospectively assessed the short-term efficacy and safety of preoperative radiotherapy followed by surgery in patients with locally high-risk STS. Methods: Data from consecutive patients treated with preoperative radiotherapy at Fudan University Shanghai Cancer Center from February 2021 to June 2022 were reviewed. The data included clinical characteristics, radiotherapy regimes, radiological images and pathology slides. The target volumes of radiotherapy were delineated on computed tomography (CT) simulation images with reference to fused magnetic resonance imaging (MRI) images slides by slides. All the patients received radiotherapy planned with intensity-modulated radiotherapy (IMRT). Counting data was presented as percentages. The rates of radiological response (complete response, partial response, stable disease, progressive disease, objective response and disease control), pathological response [near-pathologic complete response (near-pCR), defined as ≥90% non-viable tumor cells] and toxicities (acute skin toxicity and major wound complications occurring within 120 d of surgery) were analyzed. Results: Forty-one patients received radiotherapy before surgery, among them 33 patients were eligible: 31 for radiological assessment and 28 for pathological assessment. The median age was 53 years. Thirty (90.0%) cases were histologically classified as Grade 3. Six (19.4%) patients achieved partial response, and 1 patient had progressive disease after radiotherapy. None got complete response. The objective response rate was 19.4%, and the disease control rate was 96.8%. Near-pCR was found in 8 (28.6%) patients. Excluding patients receiving chemotherapy previously, the near-pCR rate was 34.8% (8/23). Grade 1 and 2 skin injuries were found on 33.3% (11/33) and 3.0% (1/33) patients. No grade 3 and 4 skin injury occurred. Major wound complications within 120 d of surgery occured in 1 (3.3%) patient. Conclusion: Preoperative radiotherapy facilitated with fused MRI images and IMRT has good short-term efficacy and tolerable acute toxicities for locally high-risk STS.
[Key words] Soft tissue sarcoma; Preoperative radiotherapy; Magnetic resonance imaging; Intensity-modulated radiotherapy; Objective response rate; Wound complication
肉瘤是一组罕见的实体瘤,仅占所有成人恶性肿瘤的1%[1]。软组织肉瘤(soft tissue sarcoma,STS)可发生于身体的各个部位,包括四肢、躯干、内脏、腹膜后或头颈部等。尽管发病率低,但STS的预后并不乐观。
整块切除是局部STS的主要治疗方法。足够的手术切缘对于局部控制和生存都至关重要[2]。但STS多位于深筋膜、腹腔内或腹膜后,发现时通常已经浸润周围组织或邻近的重要解剖结构,直接手术难以获得满意的切缘。围手术期放疗联合手术是局部高危STS的标准治疗方案[1]。与单纯手术相比,放疗联合手术可减少局部复发,提高生存率。与术后辅助放疗相比,术前放疗显示出一定优势,如提高R0切除率、减少局部复发等[3-4]。同时,术前放疗时靶体积更小,放疗剂量更低,晚期不良反应更低,器官功能保留更好[4-5]。然而,术前放疗的主要缺点是其对伤口愈合的影响[6]。当考虑围手术期放疗时,严重伤口并发症是非常令人担忧的问题之一。
随着放疗技术的发展,放疗从二维放疗发展到三维适形放疗,再到调强适形放疗(intensity-modulated radiotherapy,IMRT)。IMRT使放疗的等剂量线更贴合靶区,减少对周围正常组织的辐射,从而减少不良反应[7-8]。另一方面,由于STS的特性,在传统的计算机体层成像(computed tomography,CT)图像上,STS与周围肌肉等组织的分界不清。随着影像学技术的更新,磁共振成像(magnetic resonance imaging, MRI)提供了更多区分不同软组织成分的信息。MRI使术前放疗的优势更加明显,基于MRI的靶区勾画使放疗靶区更小,毒性反应更低[9]。
一方面,可以将MRI图像融合至模拟定位CT图像上以精准勾画靶区,另一方面,可以利用IMRT技术制订放疗计划,旨在减少伤口并发症并改善预后。本研究旨在回顾性分析这种方式对局部高危STS的影像学应答、病理学应答及治疗安全性的影响。
1 资料和方法
1.1 患者纳入和排除标准
回顾性分析复旦大学附属肿瘤医院接受放疗的STS患者资料库,纳入2021年2月—2022年6月接受放疗作为术前治疗的连续性患者。纳入标准:① 年龄>14岁;② 经组织学检查证实为基于2020年世界卫生组织(World Health Organization,WHO)软组织肿瘤分类的STS,不包括胃肠道间质瘤(gastrointestinal stromal tumor,GIST)、骨肿瘤;③ 局部高危为不可切除或临界可切除(如肿块大于5 cm、邻近或包围血管或神经),或复发性肉瘤;④ 完成术前放疗;⑤ 放疗前4周内有影像学记录;⑥ 放疗后4周内有影像学记录,或经术前放疗后手术标本可供病理学评估。排除标准:① 既往在同一区域内接受放疗;② 短程放疗后立即手术(无法评估短期效果);③ 接受放疗但未按计划进行治疗。
1.2 治疗方法
所有患者均接受了IMRT技术的术前放疗,联合或不联合全身化疗。
所有患者有与定位CT相同体位下的MRI图像。参考融合的MRI图像,并根据美国肿瘤放射治疗协作组(Radiation Therapy Oncology Group,RTOG)共识[10],在模拟定位CT上勾画靶区。大体肿瘤靶区(gross tumor volume, GTV)定义为原发病灶。临床靶区(clinical target volume,CTV):根据GTV,在纵向轴上外扩3~4 cm,在横断方向上外扩1.0~1.5 cm,或手动编辑以包含MRI T2加权图像上可疑的瘤周水肿;CTV缩回至天然屏障,例如,间室的边界、完整的筋膜屏障、骨骼或皮肤表面等。计划靶区(planned target volume,PTV):根据病灶的不同部位和不同的固定装置,将CTV外扩0.3~0.8 cm。
所有放疗计划均采用IMRT技术。放疗主要采用常规分割,如果病变进展快则采用超分割,或在少数患者中采用大分割。处方剂量为生物有效剂量(biological effective dose,BED)=45~65 Gy(α/β=10),局部加量可至70 Gy。
危及器官根据RTOG共识[10]限制剂量体积。对于将来可能用于关闭手术创面的皮肤/皮下组织(虚拟手术皮瓣),剂量体积限制更严格。
根据病理学亚型,在放疗前后或放疗期间允许进行全身治疗,包括基于蒽环类药物的方案、异环磷酰胺/环磷酰胺、依托泊苷、长春新碱化疗,或靶向治疗、免疫治疗等。手术进行以保肢为目的的整块切除。
1.3 疗效评价
根据实体瘤疗效评价标准(Response Evaluation Criteria in Solid Tumors,RECIST)1.1版[11]评估放疗后的影像学应答,包括完全缓解(complete response,CR)、部分缓解(partial response,PR)、疾病稳定(stable disease,SD)、疾病进展(progressive disease,PD)、客观缓解率(objective response rate,ORR)及疾病控制率(disease control rate,DCR)。
病理学应答定义为无活性肿瘤的百分比。接近病理学完全缓解(near-pathologic complete response,near-pCR)定义为≥90%的无活性肿瘤细胞[12]。
手术切缘按R0/R1/R2分类。
根据O’Sullivan等[6]和Ashleigh Guadagnolo等[13]制定的标准定义严重伤口并发症,即术后120 d内发生以下情况:在全身或局部麻醉下进行二次手术以修复伤口、为治疗伤口再次入院、为护理伤口进行的侵袭性操作等。
根据欧洲癌症治疗研究组织(European Organization for Research on Treatment of Cancer,EORTC)/RTOG共识[10]对术前放疗的并发症进行评估。急性皮肤损伤评分为0~4级。其他并发症按常见不良反应术语评定标准(Common Terminology Criteria for Adverse Events,CTCAE)5.0版[14]进行评价。
1.4 统计学处理
计数资料采用百分数表示。对影像学应答(CR、PR、SD、PD、ORR及DCR)比例、near-pCR比例及毒性反应(急性皮肤损伤和术后120 d内伤口并发症)比例进行分析。
2 结 果
2.1 筛选的患者及其临床特征
本研究的筛选过程见图1。共41例肉瘤患者于2021年2月—2022年6月在复旦大学附属肿瘤医院接受了术前放疗。8例患者因以下原因予以排除:2例接受了术前放疗但因新型冠状病毒肺炎(COVID-19)疫情未按计划治疗,3例短程放疗后立即手术(无法评估疗效),3例失访(放疗后未进行影像学或病理学评估)。剩余33例患者可接受影像学或病理学评估。对于影像学评估,排除2例患者丢失放疗后复查图像。对于病理学评估,共排除5例患者:1例拒绝手术、2例放疗结束后接受延迟手术(超过4个月)、2例影像学复查后失访。总共31例患者可进行影像学评估,28例患者可进行病理学评估。
患者的临床特征见表1。诊断时患者的中位年龄为53岁(15~73岁)。其中15例(45.5%)肿瘤位于下肢,11例(33.3%)肿瘤位于躯干。根据法国国家癌症研究中心(French Federation Nationale des Centres de Lutte Contre le Cancer,FNCLCC)分级系统[15],30例(90.9%)肿瘤为3级。27例(81.8%)肿瘤直径>5 cm,其中近一半(13/27)肿瘤直径>10 cm。13例(39.4%)病灶为初治原发,20例(60.6%)为复发或转移。根据2020年WHO软组织肿瘤分类[16],常见的组织学亚型是多形性未分化肉瘤(5例)、横纹肌肉瘤(4例)和滑膜肉瘤(4例),详见表2。
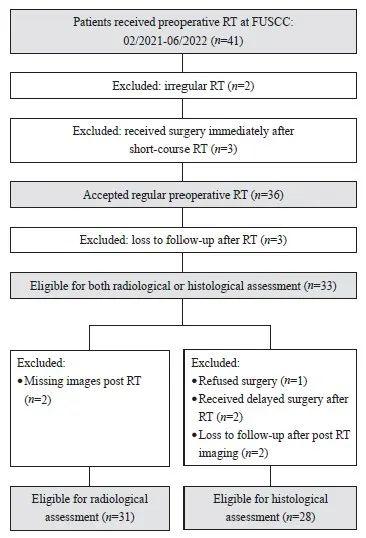
图1 研究对象纳入流程图
Fig. 1 Research object inclusion flowchart
RT: Radiotherapy; FUSCC: Fudan University Shanghai Cancer Center.


2.2 最终治疗选择
31例(93.9%)患者接受了常规分割放疗(1.8~2.0 Gy/次,每周5次);1例患者接受了大分割放疗;因为肿瘤进展快,3例患者在开始时或常规放疗数次之后接受了加速超分割放疗(每天2次)。13例(39.4%)患者接受了局部加量放疗。PTV的中位BED为55.2 Gy(46 Gy/23次)(46.7~62.3 Gy),如果包括加量,中位BED为60.0 Gy(50 Gy/25次)(48.0~67.1 Gy)。
21例(63.6%)患者同时接受了全身治疗。其中15例使用了化疗,主要为AI方案(多柔比星60 mg/m2或脂质体多柔比星30 mg/m2,第1天,异环磷酰胺1.8 g/m2,第1~5天,每3周1次)[10例,1~3个疗程(中位2个疗程)]、VAC/IE交替方案(VAC:长春新碱1.5 mg/m2,最多2.0 mg,第1天,多柔比星30 mg/m2,第1~2天,每3周1次,环磷酰胺1.2 g/m2,第1天;IE:异环磷酰胺1.8 g/m2,第1~5天,依托泊苷100 mg/m2,第1~5天,每3周1次)(3例,分别使用3、4和5个疗程)、VDC方案(长春新碱1.5 mg/m2,第1、8、15天,多柔比星30 mg/m2,第1~2天,环磷酰胺1.2 g/m2,第1天,每3周1次)(2例,分别使用了2和3个疗程);3例使用靶向治疗(安罗替尼,10 mg,第1~14天,每3周1次,均使用了3个疗程);1例使用了化疗联合靶向治疗(AI方案联合安罗替尼,共3个疗程);2例使用了靶向治疗联合免疫治疗(安罗替尼联合PD-1单抗治疗,共2个疗程)。
30例患者经术前治疗后在复旦大学附属肿瘤医院接受了根治性手术,均达到R0切除。对于肢端肿瘤患者,所有肢体都得以保留。新辅助放疗结束与手术的中位间隔时间为4.4周(0.9~28.6周)。
2.3 放疗后的影像学应答和病理学应答
放疗后的影像学应答见图2。31例患者可进行影像学评估,6例(19.4%)达到PR(2例横纹肌肉瘤、1例滑膜肉瘤、1例平滑肌肉瘤、1例恶性蝾螈肿瘤和1例梭形细胞肉瘤),没有患者达到CR,ORR为19.4%。1例滑膜肉瘤患者在放疗后出现PD,此前她曾两次在手术不久后发生复发。总体的DCR为96.8%。
28例患者可进行病理学评估,8例(28.6%)达到near-pCR(2例横纹肌肉瘤、2例滑膜肉瘤、1例骨外尤因肉瘤、1例其他圆形细胞肉瘤、1例黏液纤维肉瘤和1例恶性蝾螈瘤)。既往接受过化疗的患者均未达到near-pCR。排除这些患者后,near-pCR率为34.8%(8/23)。此外,1例多形性未分化肉瘤患者的手术标本中未发现存活肿瘤细胞,该患者在放疗后28.6周接受了手术,未纳入统计。
对比影像学应答和病理学应答结果,66.7%(4/6)的影像学PR患者获得near-pCR,另外2例患者的手术标本中分别有≥70%和≥50%的无活性肿瘤细胞。另一方面,50%(4/8)near-pCR患者取得了影像学PR,其他3例患者仅达到SD,另1例患者在放疗后丢失复查图像。其中1例肿瘤位于股骨旁,最大径为骨膜方向的长轴,无明显变化,因此影像学疗效评价为SD,但横截面积明显减小,总体积实际缩小了90%,术后病理学检查显示,存活肿瘤细胞<5%。此外,另1例评价为SD但达到near-pCR的肿瘤,MRI图像显示,放疗后瘤内坏死比治疗前明显增加,但即使根据Choi标准,这种变化亦未达到PR,这例患者治疗后氟代脱氧葡萄糖-正电子发射体层成像(fluorodeoxyglucose-positron emission tomography,FDG-PET)图像上显示为低摄取,当时不能明确区分肿瘤或炎症,但术后病理学检查未见存活肿瘤细胞。
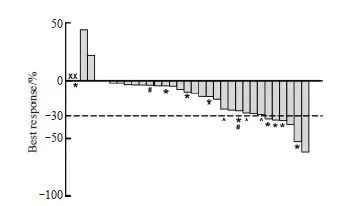
图2 术前放疗效果
Fig. 2 Efficacy of preoperative radiotherapy
Plot shows dimensional change in target lesions as a percentage of the baseline measurement. Lower dashed lines represent the cutoffs for partial response (30% decrease in the sum of diameters of target lesions). X: Lost the reexamination images after radiotherapy; *: Near-pCR; #: Received delayed surgery; ^: Refused surgery or lost to follow-up.
2.4 安全性
33.3%(11/33)患者在放疗期间或放疗结束后出现1级皮肤损伤,主要表现为微弱或暗淡的红斑、色素沉着及干性脱皮。3.0%(1/33)患者出现2级皮肤损伤,伴有片状的湿性脱皮,对症处理后缓解。未发生3、4级皮肤损伤。此外,1例患者因皮下肿瘤进展导致放疗野出现皮肤破溃,术中将破溃与肿瘤一并切除。
术后的中位随访时间为8个月(4~20个月)。1例(3.3%)患者在手术后120 d内发生了严重伤口并发症。其肿瘤位于躯干(臀部),患者在放疗后第20天接受了手术。术后持续引流,遂进行了二次手术。二次手术后伤口愈合良好。但这1例患者并非上述发生2级皮肤损伤的患者。
3 讨 论
肉瘤是一类罕见但具有很强异质性的实体瘤,每年发病率为2.38~5.00/100 000人。国内关于STS放疗的报道不多,且大多是姑息性放疗或无手术机会时的根治性放疗[17],而关于术前放疗的数据很少,较著名的是一篇北京积水潭医院纳入19例患者的研究[18]。本研究共纳入33例患者,ORR为19.4%,DCR为96.8%,near-pCR率为28.6%,伤口并发症发生率为3.3%,表明本研究的术前放疗方案有良好的近期疗效和安全性。
对于局部高危STS,多学科综合治疗必不可少。因为单纯手术难以获得很好的局部控制,单纯新辅助化疗亦未能获得显著的生存获益[19- 20],对于这部分患者,指南推荐围手术期放疗联合手术[1],但来自大规模临床试验的证据已经非常久远[6]。虽然来自发达国家的回顾性分析和一些Ⅱ期临床试验的数据已经发表,但术前放疗并未广泛应用于局部高危STS患者,这部分患者的生存明显差于依从指南治疗的患者[21]。
由于STS很罕见而且病理学亚型非常复杂,几乎所有的报告都仅纳入了有限的样本量和不同的病理学亚型,导致数据有较大的异质性。总的来说,术前放疗的剂量大多在50 Gy/25次左右,也有稍大分割42.75 Gy/15次或大分割30 Gy/5次。
本研究中,术前放疗的中位剂量为50 Gy/25次,病理学评估near-pCR率为28.6%,低于北京积水潭医院报道的47.4%[18],但高于ARST1321研究中放化疗组的22.2%[12]和回顾性研究中单独放疗的9.0%[22]。另一方面,本研究的PR率为19.4%,因既往接受过化疗的患者均未达到near-pCR;排除这些患者后,near-pCR率明显升高(34.8%),与北京积水潭医院报道的31.6%[18]类似,低于ARST1321研究中按体积定义的58.0%[12]。这也提示化疗抵抗,特别是获得性抵抗的STS对放疗敏感性可能也不是很高。远期疗效还需要进一步随访。
长期以来,一直没有可靠的影像学或病理学标准来评价STS术前治疗效果,这在本研究及其他研究[12,18]中均有体现。病理学上用得最广泛的指标是病理坏死百分比,但临界值并不统一。此外,还有基于EORTC-软组织和骨肉瘤组织(Soft Tissue and Bone Sarcoma Group,STBSG)反应评分、存活细胞百分比、玻璃样变/纤维化等指标[22]。对于影像学评估,RECIST和Choi评价的结果并不总是一致的[23]。最近18F-FDG PET/CT研究[24]表明,实体瘤中治疗后18F-FDG摄取减少可能与良好病理学反应有关,但在某些情况下,如本研究中的患者,18F-FDG低摄取时并不容易区分肿瘤残留和炎症。因为术前治疗的不同评价标准与患者预后的关系还不明确,对于包括本研究在内的术前治疗的总体获益,需要长期随访以获得局部控制和生存数据。
尽管术前放疗与术后放疗相比呈现出一定的优势,包括生存获益和长期毒性等,但由于担心急性的伤口并发症的发生,术前放疗在临床实践中难以推广。Yang等[25]的系统研究显示,术前放疗对比术后放疗可能增加并发症,主要为急性并发症。不同研究中术前放疗的伤口并发症发生率在3%~37%之间,稍大分割 42.75 Gy/15次[13]或大分割30 Gy/5次[26]并未明显降低伤口并发症。Davis等[3]认为伤口并发症与放疗时机(术前或术后)、肿瘤最大径(≤10 cm或>10 cm)、解剖位置有关,与年龄等无关。Kalbasi等[26]认为伤口并发症的发生与肿瘤位置有关。O’Sullivan等[8]认为伤口并发症与皮瓣的放射剂量体积显著相关。但Huang等[18]认为伤口并发症与肿瘤大小(<5 cm或 ≥5 cm)、肿瘤位置、放疗与手术间隔、放疗后皮肤损伤、皮瓣及年龄均无显著相关性。ARST1321研究[12]提示放化疗联合靶向治疗对比单纯放化疗会增加伤口并发症,但仅限于同一个研究内的不同组间的区别,与其他研究比较不能得到类似结论。本研究中,术后120 d内严重伤口并发症的发生率为3.3%,与ARST1321研究中放化疗组(2.8%,1/35)相似,低于既往其他报道(30%左右)[3,5, 8,18,27]。对于晚期不良反应,包括纤维化、关节僵硬和水肿等,还需进一步随访。
虽然需要长期随访,但结合对比本研究数据和其他类似研究的数据提示,利用MRI图像融合技术和IMRT技术的术前放疗对于局部高危STS患者的近期疗效尚可,不良反应可控,为术前放疗的可行性提供了依据,有助于术前放疗的推广。未来的研究方向包括进一步提高疗效和降低伤口并发症,以及寻找更合适的影像学和病理学评价指标。
利益冲突声明:所有作者均声明不存在利益冲突。
[参考文献]
[1] VON MEHREN M, KANE J M, AGULNIK M, et al. Soft tissue sarcoma, version 2.2022, NCCN clinical practice guidelines in oncology[J]. J Natl Compr Canc Netw, 2022, 20(7): 815-833.
[2] KAINHOFER V, SMOLLE M A, SZKANDERA J, et al. The width of rep margins influences local recurrence in soft tissue sarcoma patients[J]. Eur J Surg Oncol EJSO, 2016, 42(6): 899-906.
[3] DAVIS A M, O'SULLIVAN B, BELL R S, et al. Function and health status outcomes in a randomized trial comparing preoperative and postoperative radiotherapy in extremity soft tissue sarcoma[J]. J Clin Oncol, 2002, 20(22): 4472-4477.
[4] SAMPATH S, SCHULTHEISS T E, HITCHCOCK Y J, et al. Preoperative versus postoperative radiotherapy in soft-tissue sarcoma: multi-institutional analysis of 821 patients[J]. Int J Radiat Oncol Biol Phys, 2011, 81(2): 498-505.
[5] DAVIS A, OSULLIVAN B, TURCOTTE R, et al. Late radiation morbidity following randomization to preoperative versus postoperative radiotherapy in extremity soft tissue sarcoma[J]. Radiother Oncol, 2005, 75(1): 48-53.
[6] O’SULLIVAN B, DAVIS A M, TURCOTTE R, et al. Preoperative versus postoperative radiotherapy in soft-tissue sarcoma of the limbs: a randomised trial[J]. Lancet, 2002, 359(9325): 2235-2241.
[7] FOLKERT M R, SINGER S, BRENNAN M F, et al. Comparison of local recurrence with conventional and intensity-modulated radiation therapy for primary soft-tissue sarcomas of the extremity[J]. J Clin Oncol, 2014, 32(29): 3236-3241.
[8]O’SULLIVAN B, GRIFFIN A M, DICKIE C I, et al. Phase 2 study of preoperative image-guided intensity-modulated radiation therapy to reduce wound and combined modality morbidities in lower extremity soft tissue sarcoma[J]. Cancer, 2013, 119(10): 1878-1884.
[9]LI X A, CHEN X J, ZHANG Q, et al. Margin reduction from image guided radiation therapy for soft tissue sarcoma: secondary analysis of Radiation Therapy Oncology Group 0630 results[J]. Pract Radiat Oncol, 2016, 6(4): e135-e140.
[10]WANG D, BOSCH W, ROBERGE D, et al. RTOG sarcoma radiation oncologists reach consensus on gross tumor volume and clinical target volume on computed tomographic images for preoperative radiotherapy of primary soft tissue sarcoma of extremity in Radiation Therapy Oncology Group studies[J]. Int J Radiat Oncol Biol Phys, 2011, 81(4): e525-e528.
[11]EISENHAUER E A, THERASSE P, BOGAERTS J, et al. New response evaluation criteria in solid tumours: revised RECIST guideline (version 1.1)[J]. Eur J Cancer, 2009, 45(2): 228-247.
[12]WEISS A R, CHEN Y L, SCHARSCHMIDT T J, et al. Pathological response in children and adults with large unresected intermediate-grade or high-grade soft tissue sarcoma receiving preoperative chemoradiotherapy with or without pazopanib (ARST1321): a multicentre, randomised, open-label, phase 2 trial[J]. Lancet Oncol, 2020, 21(8): 1110-1122.
[13]ASHLEIGH GUADAGNOLO B, BASSETT R L, MITRA D, et al. Hypofractionated, 3-week, preoperative radiotherapy for patients with soft tissue sarcomas (HYPORT-STS): a single-centre, open-label, single-arm, phase 2 trial[J]. Lancet Oncol, 2022, 23(12): 1547-1557.
[14]National Cancer Institute. Protocol development cancer therapy evaluation program[EB/OL]. (2017-11-27)[2023-04-28]. https://ctep.cancer.gov/protocolDevelopment/electronic_applications/ctc.htm.
[15]COINDRE J M. Recommendations for anatamo-pathologic management of soft tissue sarcomas in the adult. Pathologists of the FNCLCC Sarcoma Group (Fédération Nationale des Centres de Lutte Contre le Cancer)[J]. Ann Pathol, 1998, 18(6): 505-511.
[16]SBARAGLIA M, BELLAN E, DEI TOS A P. The 2020 WHO Classification of Soft Tissue Tumours: news and perspectives[J]. Pathologica, 2021, 113(2): 70-84.
[17]FENG X Y, LI J, LI A M, et al. Stereotactic body radiotherapy for recurrent and oligometastatic soft tissuesarcoma[J]. World J Surg Oncol, 2022, 20(1): 322.
[18]HUANG Z, LI N, TANG Y, et al. Neoadjuvant radiotherapy for soft tissue sarcoma in China: a preliminary result[J]. Ann Transl Med, 2022, 10(8): 452.
[19]CASALI P G, ABECASSIS N, ARO H T, et al. Soft tissue and visceral sarcomas: ESMO-EURACAN Clinical Practice Guidelines for diagnosis, treatment and follow-up[J]. Ann Oncol, 2018, 29(Suppl 4): iv51-iv67.
[20]GORTZAK E, AZZARELLI A, BUESA J, et al. A randomised phase Ⅱ study on neo-adjuvant chemotherapy for ‘high-risk’ adult soft-tissue sarcoma[J]. Eur J Cancer, 2001, 37(9): 1096-1103.
[21]VOSS R K, CHIANG Y J, TORRES K E, et al. Adherence to national comprehensive cancer network guidelines is associated with improved survival for patients with stage 2A and stages 2B and 3 extremity and superficial trunk soft tissue sarcoma[J]. Ann Surg Oncol, 2017, 24(11): 3271-3278.
[22]SCHAEFER I M, HORNICK J L, BARYSAUSKAS C M, et al. Histologic appearance after preoperative radiation therapy for soft tissue sarcoma: assessment of the European organization for research and treatment of cancer-soft tissue and bone sarcoma group response score[J]. Int J Radiat Oncol Biol Phys, 2017, 98(2): 375-383.
[23]TANAKA K, OGAWA G, MIZUSAWA J, et al. Prospective comparison of various radiological response criteria and pathological response to preoperative chemotherapy and survival in operable high-grade soft tissue sarcomas in the Japan Clinical Oncology Group study JCOG0304[J]. World J Surg Oncol, 2018, 16(1): 162.
[24]WAHL R L, JACENE H, KASAMON Y, et al. From RECIST to PERCIST: evolving Considerations for PET response criteria in solid tumors[J]. J Nucl Med, 2009, 50(Suppl 1): 122S-150S.
[25]YANG X, ZHANG L, YANG X, et al. Oncologic outcomes of pre- versus post-operative radiation in Resectable soft tissue sarcoma: a systematic review and meta-analysis[J]. Radiat Oncol, 2020, 15(1): 158.
[26]KALBASI A, KAMRAVA M, CHU F I, et al. A phase Ⅱ trial of 5-day neoadjuvant radiotherapy for patients with high-risk primary soft tissue sarcoma[J]. Clin Cancer Res, 2020, 26(8): 1829-1836.
[27]ALBERTSMEIER M, RAUCH A, ROEDER F, et al. External beam radiation therapy for resectable soft tissue sarcoma: A systematic review and meta-analysis[J]. Ann Surg Oncol, 2018, 25(3): 754-767.