卵巢高血钙型小细胞癌(smallcellcarcinomaoftheova⁃ ryhypercalcemictype,SCCOHT)目前国内尚无统计数据[1], 罕见。发病年龄通常小于40岁,中位年龄24岁[2], 2/3的患 者合并高血钙,发病与SMARCA4基因突变有关,复发率高 且预后极差,绝大多数2年内死亡,手术和铂类为基础的化 疗仍是主要治疗方案[3],但效果并不确切。现将我院收治 的1例误诊为颗粒细胞瘤的SCCOHT治疗经过报道如下。
1 病历摘要
患者20岁,因“腹胀20d”就诊于当地医院,查CA125 205kU/L,MRI:盆腹腔巨大囊实性肿瘤。2018-01-23行 “剖腹探查+右附件切除+左卵巢活检+阑尾切除+大网膜切 除+盆腔淋巴结清扫术”。术中见:少量血性腹水,右侧卵 巢囊实性肿物20cm×20cm,与腹膜粘连,术前部分肿瘤已 破裂,浑浊血性液体流出。术后病检示:卵巢成年型高分 化颗粒细胞瘤,诊断为“卵巢颗粒细胞瘤ⅠC期”。201802-08至2018-06-10行紫杉醇+卡铂化疗6个周期,化疗副 反应轻,复查CA125和MRI提示完全缓解,此后每隔3个月 复查CA125和彩超无异常。 2019年1月出现腹痛伴便秘,当地医院复查MRI:卵巢 癌复发伴盆腔腹膜网膜转移。为进一步治疗入重庆大学 附属肿瘤医院妇瘤科。初潮13岁, 3~4d/28d,末次月经 2019-01-01,未婚未育,既往史、个人史、家族史无特殊。 查体:右下腹扪及10cm大小囊实性活动包块,边界不清, 无压痛,直肠黏膜光滑。肿瘤标志物:CA125107.40kU/L, CA724 16.18 kU/L,CA199 10.39 kU/L,鳞癌抗原(SCC) 1.20μg/L,癌胚抗原(CEA)<0.50μg/L,甲胎蛋白(AFP)< 2.50μg/L,神经元特异性烯醇化酶(NSE) 4.17μg/L,人绒毛 膜促性腺激素(hCG)0.71μU/L,其中CA125和CA724升 高。电解质:血钙2.99mmol/L,血钠、血钾正常。全身浅表 淋巴结、彩超、胸部CT、胃镜、肠镜正常。盆腹腔MRI(图 1):盆腹腔多发囊实性肿块影,边界不清,范围11.3cm×10.0cm,平扫信号不均匀,增强扫描实性成分和囊壁明显 强化,盆腹腔大量积液,肠系膜及网膜增厚呈饼状。PETCT:腹膜后、腹盆腔多发肿块影,边界不清,较大者11.7 cm×12.9cm,代谢增高。 2019-01-29行剖腹探查术,术中见:血性腹水0.6L,膈 顶、肝、脾、胃未扪及异常,盆腔囊实性肿物(实性为主)18 cm×15cm,肿瘤表面见3cm破口,表面渗血,直肠及乙状结 肠壁散在乳头状病灶数枚0.5~1.0cm,子宫大小正常,后 壁受侵,与盆腔肿物无法分离,左输卵管伞端见乳头状肿 物2cm×2cm,左卵巢囊实性增大5cm×4cm,与左侧盆壁 及盆腔肿物致密粘连,膀胱反折腹膜乳头样病灶3cm×3 cm,右附件缺如,盆腔淋巴结未扪及肿大,腹主动脉旁淋巴 结增大呈囊实性8cm×6cm,上界达膈顶,与十二指肠致密 粘连。腹水未查见癌细胞。术中冰冻考虑倾向性索间质 细胞肿瘤,细胞显著异型,生殖细胞来源肿瘤不能除外。 行减瘤术(全子宫+左附件+右侧腹膜肿物+结直肠表面肿 物切除),分离乙状结肠和直肠表面肿物,考虑腹主动脉旁 淋巴结包绕腹主动脉、下腔静脉、肠系膜下动脉和十二指 肠起始部,无法完整切除,拟术后放化疗,予银夹标记淋巴 结下界。手术减瘤不彻底,残留病灶位于腹主动脉旁淋巴 结8cm×6cm,直肠表面病灶1cm×1cm。 术后病检(图2):高钙血症型小细胞癌,神经侵犯(-), 瘤栓(-)。免疫组化:CK-pan散在(+),CK5/6部分(+), CK7个别(+),CK19部分(+),CK20个别(+),EMA(+/-), CgA灶性(+),Syn灶性(+),CD56部分(+),WT-1(++), CD99(++), α-inhibin(-),MelanA(A103)(-),OCT-4(-), ki-67(+)60%,Calretinin(+),CAM5.2部分(+), D2-40(+), TLE1(+),Vimentin(+),PLAP可疑(+),CD34血管(+),ER (-),PR(-),Her-2(-),MOC31(-),Fli-1(-),CEA(-), Desmin(-),NSE(-),Nestin(-),TTF1(-),CD117(-),CD10 散在(+),INI-1(+),SOX10(-),S-100(-)。 术后第6天肛门排气排便,恢复流质饮食。术后第10 天突发腹痛,引流液呈鲜红色约0.4L,彩超示“腹膜后 10cm×6cm囊实性回声,腹腔积液”,考虑肿瘤破裂出血, 拟行血管介入栓塞止血,再行化疗和放疗,家属拒绝进一 步治疗,出院后1个月死亡。结合术后病检的形态学特点,
2 讨论
2.1 临床表现和辅助检查 SCCOHT是一种罕见的卵巢 恶性肿瘤,发病年龄9~43岁(平均24岁),常为单侧卵巢 受累,肿瘤大小6~26cm(平均15cm)。临床表现缺乏特 异性,可有腹痛、恶心、呕吐、消瘦或月经紊乱。影像学表 现为囊实性肿物,实性为主,与其他类型卵巢癌相比无明 显特征[2]。有文献报道62%的病例伴高钙血症,与肿瘤自 分泌甲状旁腺激素有关,作用于骨和肾引起血钙升高[4]。 但只有少数病例出现高血钙的临床表现,如腹痛、烦渴和 疲乏。血钙水平可用于评估疗效和预后。副癌综合征有 低钠血症、低血糖、抗利尿激素分泌和肌无力[5]。血清 CA125为25~691kU/L(平均176kU/L),CA125水平与肿 瘤负荷没有关联,转移途径与上皮来源卵巢癌类似[6]。本 例患者发病年龄19岁,临床表现为腹痛和便秘,无特异性 症状,肿瘤呈囊实性,位于右卵巢,大小21cm,转移灶位于 附件、腹膜、直肠表面、盆腹腔淋巴结,瘤体易坏死和破裂 出血,两次手术探查均见瘤体自发破裂出血,术后第10天 腹主动脉旁淋巴结破裂出血。初治时CA125为205kU/L, 术后化疗后降至正常,复发后为107kU/L,升高不明显, CA724稍有升高,SCC、CEA、AFP、NSE、hCG等正常。术前 血钙为2.99mmol/L,高于正常值,术后每隔2d复查血钙分 别为1.54、 1.87、 1.95、 2.17mmol/L,均恢复正常,可能与肿瘤 负荷减少有关。
2.2 组织病理学 SCCOHT组织发生和细胞来源不明,有 文献报道基于免疫组化及电镜认为是一种上皮性卵巢癌, 但其上皮性起源一直未被证实[3]。也有生殖细胞、性索间质、甚至神经内分泌分化来源学说相继被提出[7]。肿瘤以 小细胞弥漫片状、巢状、梁索状排列为主,细胞大小一致, 圆形或卵圆形,胞浆少,核仁明显,核分裂象多见,伴大量 坏死和出血,部分病例呈滤泡样生长,滤泡腔内含有嗜酸 性或嗜碱性液体,少数病例含有胞浆丰富的横纹肌瘤样大 细胞[8]。免疫表型以表达上皮标记(CK系列、EMA)和神经 内分泌标记(CgA、Syn、CD56)为主要特征,多数病例也可观 察到WT-1和CD99阳性表达,而生殖细胞肿瘤、性索间质 肿瘤、软组织肿瘤的标志物均为阴性表达。SMARCA4基 因突变是SCCOHT的特征性分子遗传学改变,有文献报道 69%以上的病例有SMARCA4基因突变[9-10],少数病例有 SMARCB1突变[11]。本例患者初治时外院误诊为颗粒细胞 瘤,我院术前借阅外院石蜡块病理会诊也考虑颗粒细胞 瘤,我院术中冰冻仍然诊断不明,倾向性索间质细胞肿瘤, 细胞显著异型,生殖细胞来源的肿瘤不能除外,腹水未查 见癌细胞。直至结合术后病检的形态学特点,免疫组化CK 系列、EMA、CgA、Syn、CD56、WT-1、CD99均阳性表达,及临 床有高血钙,最终确诊,可见SCCOHT诊断难度大。
2.3 治疗 SCCOHT预后极差,绝大多数2年内死亡,手术 和铂类为基础的化疗仍是主要治疗方案,但效果并不确 切,手术范围、化疗方案和放疗的地位仍有争议。Young 等[3]回顾性分析了150例SCCOHT,其中ⅠA期患者预后较 好,生存期1~13年(平均5.7年),晚于ⅠA期患者5年生存 率6%,几乎都2年内死亡,只有1例ⅡB期术后补充高强度 化疗和放疗后生存7年。ⅠA期、年龄大于30岁、术前血钙 正常、肿瘤小于10cm、病理出现大细胞成分提示预后较好。也有文献报道肿瘤大小与预后无关,明显占位性症状 有助于早期发现肿瘤,预后更好[8,12]。Gamwell等[13]回顾性 分析了17例ⅠA期患者,建议根治性手术,术后补充化疗 和放疗,因本病常见于青少年,且术中冰冻往往不能确诊, 可先常规行保留生育功能手术,术后病检确诊后再补充根 治性手术[13]。也有文献报道了ⅠA期幼女行保留生育功能 手术的尝试,但为个案,且疗效不佳。对于晚于ⅠA期患 者,根治性手术和术后化疗是主要治疗方案,对于预计减瘤 困难的病例,也可行新辅助化疗[14]。化疗方案推荐铂类为主 的联合化疗,可参考VPCBAE方案:长春新碱6mg/m2+顺铂 90mg/m2D1、环磷酰胺1g/m2+博来霉素15U/m2D2、多柔比 星60mg/m2+依托泊苷200mg/m2D3,周期21~28 d[15-16]。 Nelsen等[17]报道了3例联合盆腔放疗的疗效,其中1例腹膜 转移的病例生存5年。放疗可延长生存期,但前提为手术 彻底减瘤,对晚于ⅠA期或复发的病例疗效也并不满意,且 盆腔放疗易出现放射性肠炎、肠梗阻、肠穿孔等并发症[3]。 对于SMARCA4突变基因携带者,需严密随访血钙、CA125 和彩超,可也考虑生育后行预防性卵巢切除术[8]。
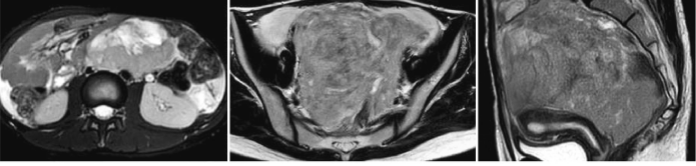
图1 盆腹腔MRI
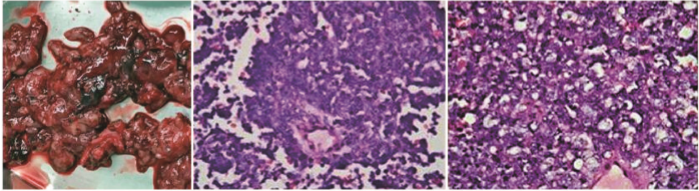
图2 术后病理标本和HE染色图(×100
免疫组化CK系列、EMA、CgA、Syn、CD56、WT-1、CD99均阳 性表达,及临床有高血钙,最终确诊为SCCOHT。
2.4 经验教训 SCCOHT病理易误诊为生殖细胞或性索 间质来源,单纯依靠病理诊断难度大,虽然发病罕见,但建 议临床医生熟悉其临床表现和辅助检查的特点,以免误 诊。本例患者初治时误诊为颗粒细胞瘤,手术范围不足且 术后补充治疗可能不合适,需要吸取教训。SCCOHT的特 点为好发于青少年,常为单侧卵巢,肿瘤较大平均15cm, 影像学表现为囊实性肿物,实性为主,可有高血钙,CA125 水平与肿瘤负荷没有关联,且CA125升高不明显,肿瘤常 伴坏死和出血,细胞体积小,如病理诊断为生殖细胞、性索 间质、小细胞神经内分泌癌或未分化癌等,需与病理医生 沟通,必要时上级医院病理会诊。建议无论分期早晚均行 根治性手术,不保留生育功能,如术中冰冻误诊为生殖细 胞或性索间质来源,已行保留生育功能手术,经术后病理 确诊后,建议补充二次手术。术后采取综合治疗,及时足 量足疗程的VPCBAE方案化疗,有条件的医院可考虑行盆 腔放疗。SCCOHT虽然预后极差,但ⅠA期、年龄大于30 岁、术前血钙正常、肿瘤小于10cm、病理出现大细胞成分 的患者经过综合治疗仍有望获得较长的生存期。目前手 术范围、化疗方案和放疗的地位有待不断探索与研究。
参考文献略。
原始出处:
何 昊,邹冬玲, 周 琦, 陈 锐等,卵巢高血钙型小细胞癌误诊为颗粒细胞瘤1例教训分析[J],中国实用妇科与产科杂志,2020,36(4)。