卟啉病是血红素生物合成过程中酶活性缺乏而引起的卟啉代谢障碍性疾病,会累及多个系统,在临床上表现多样,呈异质性,根据酶缺陷的不同共分为8种亚型[1],每种亚型临床表现各异,需要规范诊治。急性间歇性卟啉病(AIP),临床上呈急性起病反复发作,最常见为胃肠道症状起病,严重者可出现精神障碍、癫痫样发作[2],容易误诊误治。AIP属于急性肝卟啉病,容易引起肝功能异常,慢性肝纤维化、肝硬化、肝细胞癌的风险均高于正常[3]。正确的诊治对于预后至关重要,目前在AIP的治疗方面,主要方案是针对改善急性期症状的传统治疗,其中特效药血红素的疗效得到更多的循证证据。近年来一些针对病因的治疗策略在研发上也取得了进展[4-5],特别是基于RNAi基因沉默的药物吉佛西兰(Givosiran)疗效显著[6]。本文拟针对AIP的治疗和新的研发进展进行综述,期望为医务人员对该病治疗提供参考。 1病因及机制 AIP是由于卟啉合成途径的第三个酶羟甲基胆素合成酶(HMBS,又称PBGD)缺陷而引起的一种常染色体显性遗传疾病[1],导致卟啉前体δ-氨基乙酰丙酸(ALA)和胆色素原(PBG)的蓄积,其毒性作用可致腹痛、神经-精神症状,严重者危及生命[7]。与AIP发病情况类似的遗传性卟啉病还有ALA脱水酶缺陷卟啉病、遗传性粪卟啉病、变异性卟啉病,这四种亚型统称为急性肝卟啉病(AHPs),其中AIP是最常见的类型[8]。 2传统疗法 AIP急性发作时的基础疗法。高糖可干扰ALAS1的转录[11]。如果患者病情较轻时(未出现虚弱、呕吐或低钠血症),建议在开始具体治疗前48 h进行高碳水化合物饮食[1]。如果病情较重,常静脉输注葡萄糖(300~500 g/d)[12]。如果病情持续影响进食,则需要更全面的肠外营养方案[12]。目前观点认为,输注葡萄糖的方案容易获得,但是效果相对较弱,而且因为大量游离水的稀释作用会加重低钠血症,在应用时注意密切监测电解质。一些观点指出,胰岛素可以下调人肝细胞ALAS1的表达[13],葡萄糖和胰岛素的联合治疗可能更有效,但这一观点需要进一步验证[14]。总体而言,高碳水化合物疗法疗效相对较弱,而且几乎没有证据表明额外的摄入碳水化合物有助于进一步预防急性发作[12]。 血红素为以往治疗AIP的唯一特效药物。血红素不仅通过负反馈下调ALAS1的转录,还可通过干扰mRNA的稳定性或阻断成熟酶进入线粒体来降低肝脏的ALAS1水平[14]。由于血红素治疗起效慢,在重症急性发作时应立即给予静脉血红素治疗,并维持治疗4 d(血红素3~4 mg·kg-1·d-1)。通常在治疗第3天出现尿液和血清PBG降低。除偶有头痛或发热外,IHT的整体耐受性良好,亦有应用于妊娠期间[15]。观察发现,预防性输注血红素治疗可减少AIP急性发作的发生率,降低卫生保健费用,使患者有更好的满意度和生活质量[16-17]。但对于是否进行血红素预防治疗存在明显争议,不仅因为IHT存在静脉血栓形成、凝血功能异常、肝纤维化、铁超载等副作用[18],而且反复进行IHT治疗会出现疗效降低,可能机制是血红素导致慢性炎症性肝脏疾病,从而逐渐激活血红素氧合酶1表达,反而触发ALAS1高表达[19]。因此,对于血红素的临床应用要把握好指征。目前上市的血红素药物有美国的高铁血红素(hydroxyheme,商品名Panhematin)和欧洲的血红素精氨酸(heme arginate,商品名Normosang)[20]。 对于疼痛,轻度疼痛可选用对乙酰氨基酚[21],对于严重疼痛最好选择非肠道麻醉剂(吗啡、海洛因和芬太尼),哌替啶是不安全的[22]。对于恶心和呕吐,可以用奋乃静、普马嗪或昂丹司琼控制,但甲氧氯普胺认为是不安全的[21]。对于心动过速和高血压,首选的药物是β-受体阻滞剂、血管紧张素转换酶抑制剂和钙通道阻滞剂(地尔硫卓)。许多的抗癫痫药物都可以诱发AIP的急性发作,如果患者出现癫痫发作,可以用地西泮、氯硝西泮或硫酸镁控制[23],禁止使用巴比妥类药物[12]。许多药物可能会诱发卟啉病的急性发作,临床用药建议网上查询(http://www.drugs-porphyria.org)。 大概5%的患者有反复发作的急性卟啉症。患者可反复经历急性神经内脏发作、慢性症状和长期并发症[24]。低剂量的促性腺激素释放激素类似物可用来治疗与月经相关的急性卟啉病,但疗效的确切性争议很大[25]。预防性输注血红素是有益的[26],但是会出现并发症,反复输注会出现疗效降低[18-19]。肝移植和肝细胞移植也用来治疗其他治疗失败的患者,但是有许多伴发症,而且需要终生免疫抑制治疗[27-28]。目前这些治疗方法的应用需要权衡利弊。 3基因治疗 基因治疗包括缺陷基因精确的原位修复、基因增补和基因沉默。基因修复不适用于AIP的治疗,因为HMBS基因缺乏高频突变。基因增补是以HMBS基因为靶点,基因沉默以ALAS1基因为靶点(图1)。由于大部分基因不能主动进入细胞,或容易被核酸酶水解,故目前基因治疗中最重要的一个环节是选择适当的载体,不仅要考虑转染效率,也要考虑安全性、免疫原性。 该策略是将野生型HMBS DNA通过基因转导进入肝细胞,从而增加PBGD的表达量。常用载体是重组腺相关病毒(rAAV)。2016年报道的临床试验[29](NCT02076763,NCT02082860)证明接受rAAV2/5-PBGD治疗的所有病例都是安全的,在有效性方面ALA和PBG水平保持不变,但有减少患者住院治疗和血红素治疗的趋势,治疗1年后可在肝脏中检测到转基因表达。但所有患者均检测到抗AAV5的中和抗体,会影响持续疗效。另一个担忧是rAAV可以整合到宿主染色质,具有的潜在致癌风险[30]。另有一些研究[31-32]针对载体进行改造,可以增强PBGD突变蛋白的表达。 该策略选择性地将野生型HMBS mRNA导入肝细胞,以充分提高PBGD蛋白水平。脂质纳米颗粒被认为是在基因治疗中传递核酸的极有前途的非病毒载体,更安全,但转染效率较低。新近的研究[33]发现,将转录的人hPBGD mRNA采用改造后的脂质纳米颗粒包裹,经静脉给药后,可呈剂量依赖性诱导小鼠肝细胞内的PBGD蛋白表达,使尿卟啉前体排泄迅速转阴。目前该方案还没有进入临床研究阶段,但2020年7月报道研发了针对AIP的药代动力学-药效动力学模型,提示该研发方向具有前景[34]。该策略不仅有望改善肝细胞的卟啉障碍,还可能改善其他细胞血红素的代谢,比如神经细胞,其关键焦点在于如何进一步提高转染效率。 该策略将特异性的小干扰RNA(siRNA)引入肝细胞,针对体内ALAS1 mRNA进行沉默,从而降低ALAS1的表达,减少ALA和PBG的产生。该研究方向取得了振奋人心的突破,研发药物Givosiran疗效确切和安全可靠,于2019年11月美国食品与药品监督管理局(FDA)批准上市。该药物的研发关键点采用了一种新的靶向递送技术,比纳米粒递送技术更为稳定[35]。在前期的Ⅰ期临床治疗中(NCT02452372),发现Givosiran可抑制肝内ALAS1的合成,使具有神经毒性的ALA和PBG水平接近正常[36]。进一步的多中心、安慰剂对照、双盲随机前瞻性研究Ⅲ期临床试验ENVISION(NCT03338816),纳入了94例急性肝卟啉症患者,48例Givosiran治疗,46例安慰剂治疗,复合性评价指标为需要进行紧急医疗或静脉输注血红素的发作率,其中期结果显示Givosiran组较安慰剂组卟啉症发作减少了70%[37],最终结果显示减少了74%[38]。和季度给药相比,每月1次给药可以更持久地降低ALA和PBG。每月给药后,在2.5 mg/kg和5.0 mg/kg的剂量下,尿ALA水平下降到正常高值以下,比基线下降约95%[39]。多项数据[38, 40]显示Givosiran具有独特疗效,因此被FDA批准用于治疗AHPs的成年患者,推荐剂量为2.5 mg/kg,每月1次皮下注射。平均的发作率和腹痛等症状明显改善,但肝脏和肾脏的不良事件增多,需定期监测患者的过敏反应和肾功能、肝功能。该策略为对ALAS1的沉默,故对所有的AHPs患者均有效,但同时可能的风险会导致肝脏血红素合成减少,其长期预后和影响需要更多数据佐证。另外该药价格昂贵(57.5万美元/年),医保外用药负担较重。 4酶替代治疗 PBGD的替代治疗于本世纪初开始研发,但后序的研究发现,外源性注射PBGD能够降低血浆中的PBG浓度,但未达到临床获益,可能该酶作用时间短且缺乏肝细胞的靶向性,尚不适合临床应用[14]。最近的一项研究[41]筛选出4种药物分子伴侣,可增强PBGD的稳定性和对胃酶的抵抗,可有助于研发口服的PBGD药物。 5总结 综上所述,对于罕见病AIP的治疗,近年来取得了重大进展,基因治疗已成为罕见病的潜在的治疗方式,Givosiran被FDA认定为具有突破性的疗法,其研发成功不仅是AIP治疗史的重要里程碑事件,而且在罕见病的治疗史上也是浓墨重彩的一笔。葡萄糖仍然是最基本的治疗,特效药血红素取得了更多的证据,新研药物Givosiran有待更长的观察。目前我国对于AIP急性发作的主要治疗为静脉输注葡萄糖,而血红素和Givosiran在我国缺乏相应的临床数据,而且不易购买。
2.1 高碳水化合物疗法
2.2 静脉注射血红素(IHT)
2.3 对症治疗
2.4 反复发作AIP的治疗
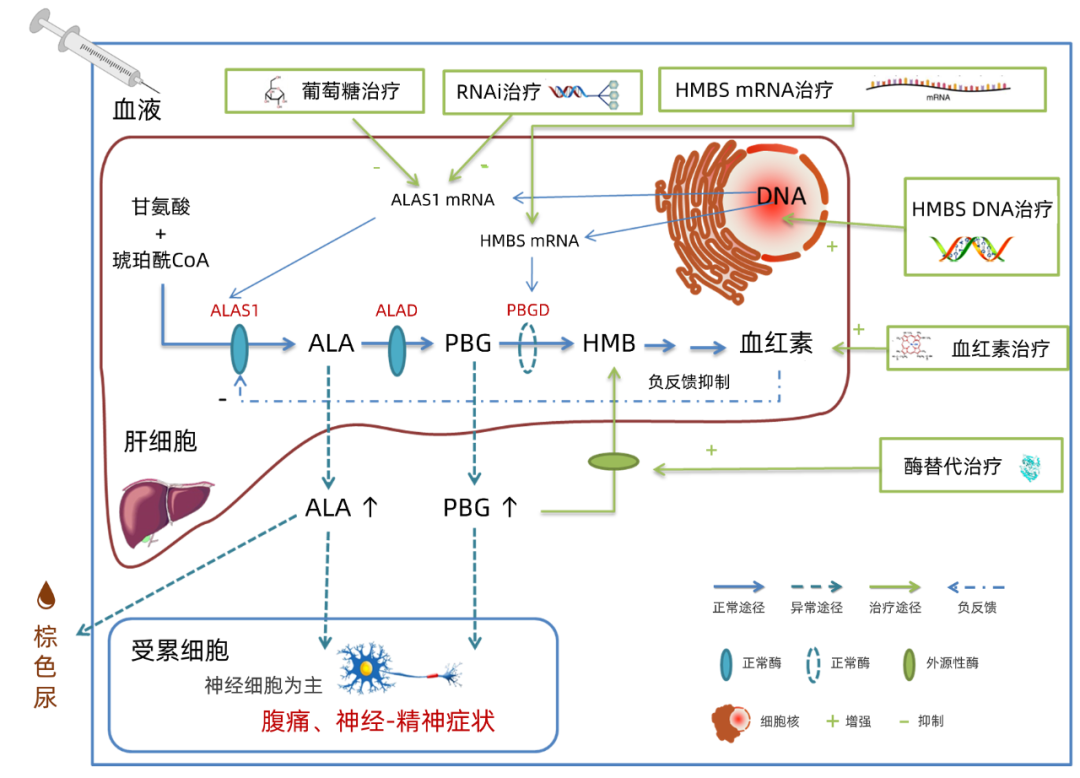
3.1 基因增补DNA
3.2 基因增补mRNA
3.3 基因沉默