CAR-T第二原发恶性肿瘤
CAR-T细胞疗法在血液恶性肿瘤中获得巨大成功,但也伴随着一些安全性问题,例如比较关注的细胞因子释放综合征和免疫效应细胞相关神经毒性综合征,此外T细胞淋巴瘤作为第二原发恶性肿瘤 (SPM)是 CAR-T 治疗后临床罕见但影响较深的不良事件。美国FDA曾宣布在 CAR-T 输注后两年内收到22例来自患者的 T 细胞淋巴瘤病例,3例证实在恶性克隆中含有 CAR 转基因,怀疑CAR-T 在 SPM 发生中具有作用。从机制上看,CAR-T的一个特定的载体整合位点可能会增强抗癌能力,但也可能增加插入致癌的风险。因此,FDA已要求对所有市售CAR-T产品中的SPM进行终生监测,以及更新CAR-T细胞疗法的黑框警告,提醒发生继发性T细胞恶性肿瘤的风险增加。这一风险警告引起全球关注,目前已有多篇关于CAR-T后第二原发恶性肿瘤的大样本回顾性分析报道,但尚缺乏CAR-T治疗后第二原发恶性肿瘤的全面概况。
基于此,中国多位学者基于全球药物警戒数据库FAERS 和 VigiBase,使用真实世界大规模数据全面阐明 CAR-T 治疗后 SPM 的当前格局,有助于指导未来 CAR-T 产品的终身安全监测。研究结果近日发表于《EClinicalMedicine》,也是首个使用 FAERS 和VigiBase数据库分析CAR-T 治疗后整体 SPM 特征的研究。

研究结果
FAERS 是由患者、医疗保健专业人员和制药公司提交的药物安全性报告的公开数据库,由乌普萨拉监测中心开发和维护的 VigiBase 是全球最大的包含全球报告的药物潜在副作用的药物警戒数据库。
该研究基于全球药物警戒数据库FAERS 和 VigiBase,提取血液恶性肿瘤 (HM) 患者具有明确 SPM 的不良事件报告 (2017–2023),使用报告比值比 (ROR) 和校正 ROR 进行比例失衡分析,以评估 SPM 和 CAR-T 治疗之间的相关性。通过发病时间(Time-to-onset)分析探讨影响 SPM 表现的因素。
CAR-T治疗后的SPM概况
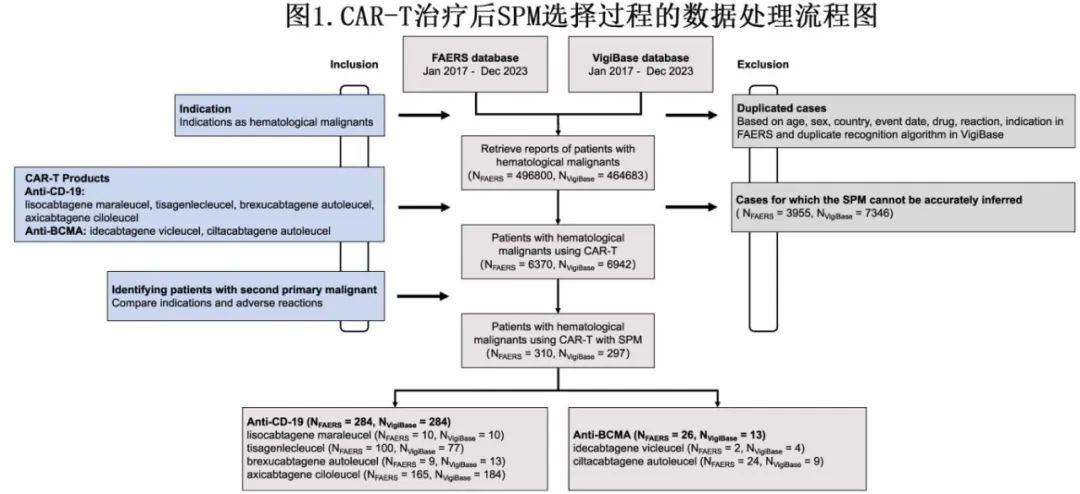
作者分别从 FAERS 和 VigiBase 数据库接受CAR-T的HM患者中提取了310例和297例SPM(图1)。
从 FAERS 和 VigiBase 中共分别鉴定出19种和16种SPM(每种 SPM 最少3例)(图2A–D)。如时程图所示,CAR-T治疗后,每年报告的原始计数和 SPM占总体AE的百分比几乎都有增加的趋势。同时,随着时间的推移,实体瘤的总计数出现轻微增加,在过去三年中,年百分比似乎在2%左右趋于稳定(见图2A 和B)。骨髓增生异常综合征 (MDS) 是 FAERS 和 VigiBase 研究中最常报告的血液学SPM 亚型(分别为n=112和115),而基底细胞癌和皮肤鳞状细胞癌(各n=14)是 FAERS 和 VigiBase 研究中最常报告的实体瘤 SPM 亚型。FAERS 和 VigiBase 报告较多的其他 SPM 包括急性髓系白血病(分别为n=55和52)和 T 细胞淋巴瘤(分别为n=13和8)(图2C 和D)。FAERS 数据库有15例 SPM 病例,包括13例 T 细胞淋巴瘤和2例大颗粒淋巴细胞增多症;其中5例死亡。
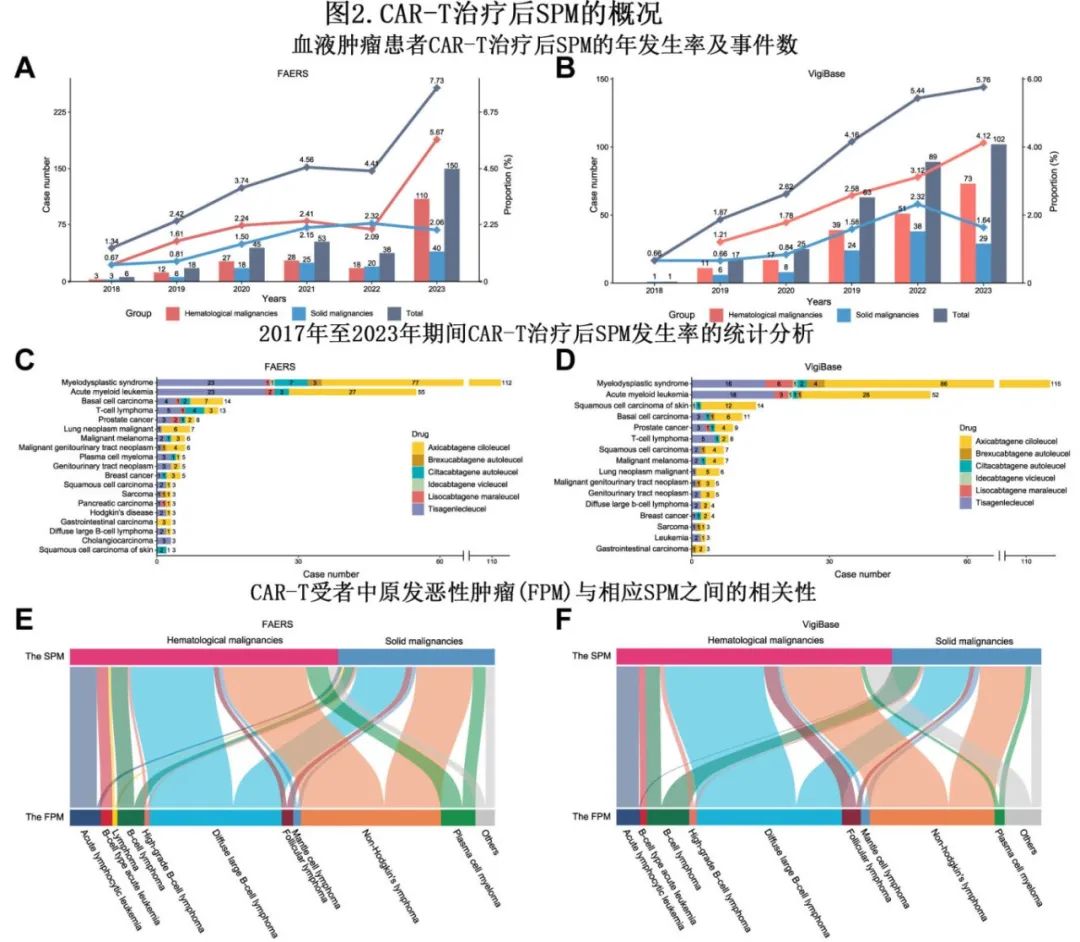
从 FAERS 推导出的 Sankey 图直观地描述了第一原发恶性肿瘤(FPM)和 CAR-T 治疗后报告的 SPM之间的演化轨迹。对该图的分析显示一个值得注意的趋势,即起源于白血病的 SPM 主要为HM而非实体瘤;但没有发现其他明显的分层模式(图2E 和 F)。
接受和未接受CAR-T治疗的血液恶性肿瘤患者的临床特征
作者比较了接受和未接受 CAR-T 治疗的 HM 患者的人口统计学和临床特征。FAERS 和 VigiBase 中不同年龄组、性别、报告地区、报告年份和 FPM 均存在显著差异(均为P<0.001)。在 FAERS 和 VigiBase 中,SPM报告主要来自美国或美洲地区,而与非CAR-T接受者相比,CAR-T 接受者更年轻、男性比例更高。值得注意的是,在 FAERS 和 VigiBase 中,对于淋巴瘤作为第一原发恶性肿瘤,CAR-T受者中的比例显著高于非CAR-T受者(74.58% vs 17.05%和76.18% vs 15.32%),而骨髓瘤显著低于非CAR-T受者(9.57% vs 55.18%和7.38% vs 60.12%)。值得注意的是,VigiBase数据库观察到 CAR-T 受者的重度结局比例显著高于非受者 (93.94% vs 57.43%,P<0.001),但该差异在 FAERS 中不显著。重要的是,在FAERS(4.87% vs 3.39%,P<0.001) 和VigiBase(4.28% vs 2.32%,P<0.001) 中,CAR-T治疗后报告的疑似 SPM 比例显著高于非CAR-T受者。
CAR-T治疗后SPM的数据挖掘
作者进一步在 HM 患者中进行比例失衡分析,以确定SPM 是否是 CAR-T 治疗后高度怀疑的安全性信号。在 FAERS 和 VigiBase 中,CAR-T治疗后的 SMP 按报告风险比(ROR)排序。T 细胞淋巴瘤 (ROR:16.49)、胃肠道癌 (ROR:8.44)、肉瘤 (ROR:7.60)、MDS(ROR:5.67) 和急性髓系白血病 (AML;ROR:3.21) 是FAERS 中发现的 CAR-T 治疗后阳性安全性信号。来自 VigiBase 的数据几乎证实该结果,并发现鳞状细胞癌作为额外 SPM 信号(ROR:2.07;图3A 和B)。根据 CAR-T 产品的作用靶点将数据进一步分层为 CD19 和 BCMA 亚组;在 CD-19 亚组中鉴定出的 SPM 与整组分析的结果几乎相同,而在 BCMA 亚组中,只有 T 细胞淋巴瘤和MDS是CAR-T 治疗后的主要SPM(图3A和B)
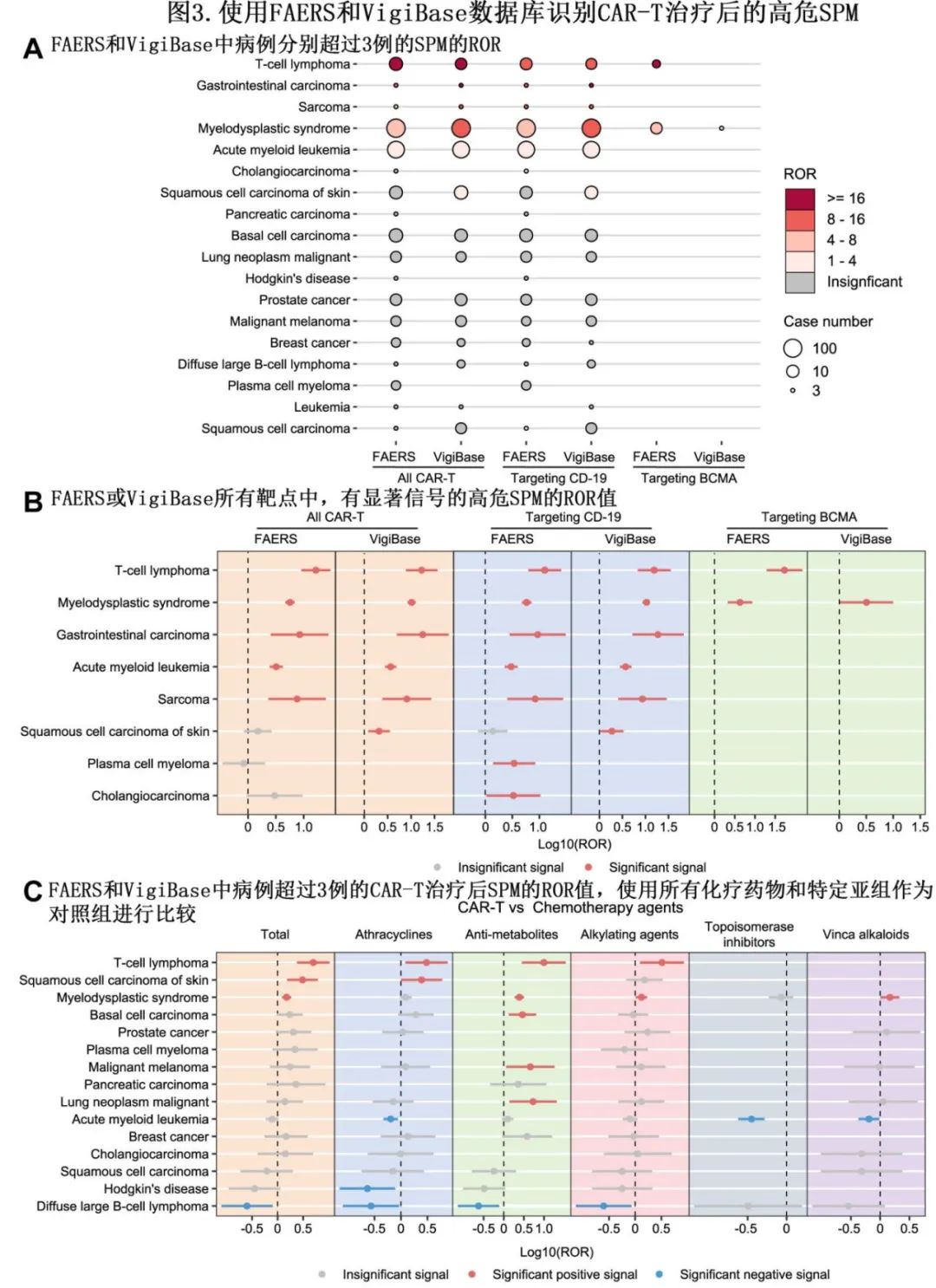
为了进一步研究 CAR-T 治疗后 SPM 的风险是否高于单纯化疗,阳性信号定义为 AE 数量不少于3例且 ROR 的 95%CI 下限超过1例。如果评估的 SPM 符合 FAERS 和 VigiBase 的阳性信号标准,则将其分级为 CAR-T 治疗后的潜在高危SPM。作者在 FAERS 中进行了亚组分析,比较了接受 CAR-T 治疗的患者和接受化疗的患者之间 SPM 的发生率。CAR-T受者某些 SPM 的发生率较高,如 T 细胞淋巴瘤 (ROR:5.00)、皮肤鳞状细胞癌 (ROR:3.08) 和MDS(ROR:1.50)(图3C)。但阳性 SPM 信号在烷化剂、抗代谢物、蒽环类药物或生物碱的不同亚组中存在差异。此外值得注意的是,T细胞淋巴瘤和 MDS 在总体分析和大多数亚组分析中均一致出现为阳性信号(图3C)。
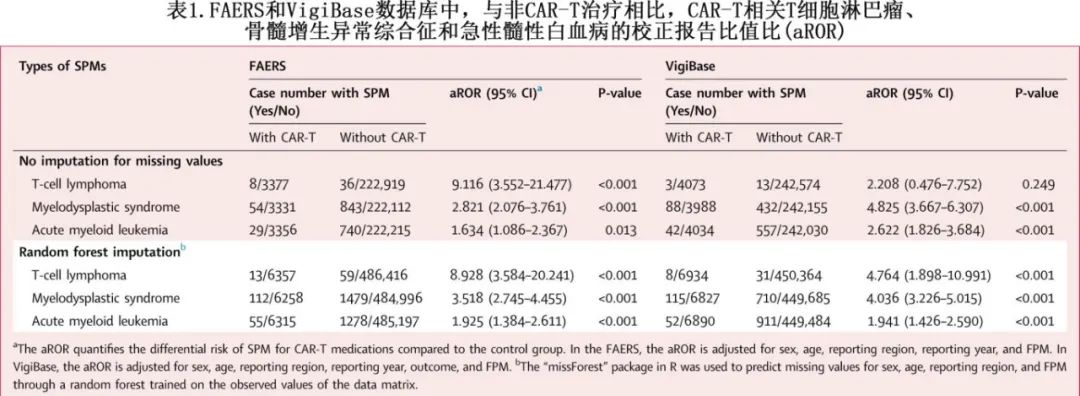
为了控制其他混杂因素对 SPM 发病率的影响,使用来自 FAERS 的数据进行了多变量逻辑回归分析,控制患者的性别、年龄、报告地区、报告年份和 FPM 亚型(白血病、淋巴瘤或MM),并计算 aROR 及其95%置信区间 (CI)。插补缺失值后发现,CAR-T 治疗后 SPM 信号阳性包括 T 细胞淋巴瘤 (aRORFAERS:8.93;aRORVigiBase:4.76)、MDS(aRORFAERS:3.52;aRORVigiBase:4.04[3.23-5.02]) 和AML(aRORFAERS:1.93;aRORVigiBase:1.94)(表1)。与仅接受化疗的 HM 患者相比,在插补缺失值并校正患者的性别、年龄、报告区域、报告年份和 FPM 亚型后,通过多变量逻辑回归分析再次确定T 细胞淋巴瘤的 SPM 信号 (aROR:3.42)。
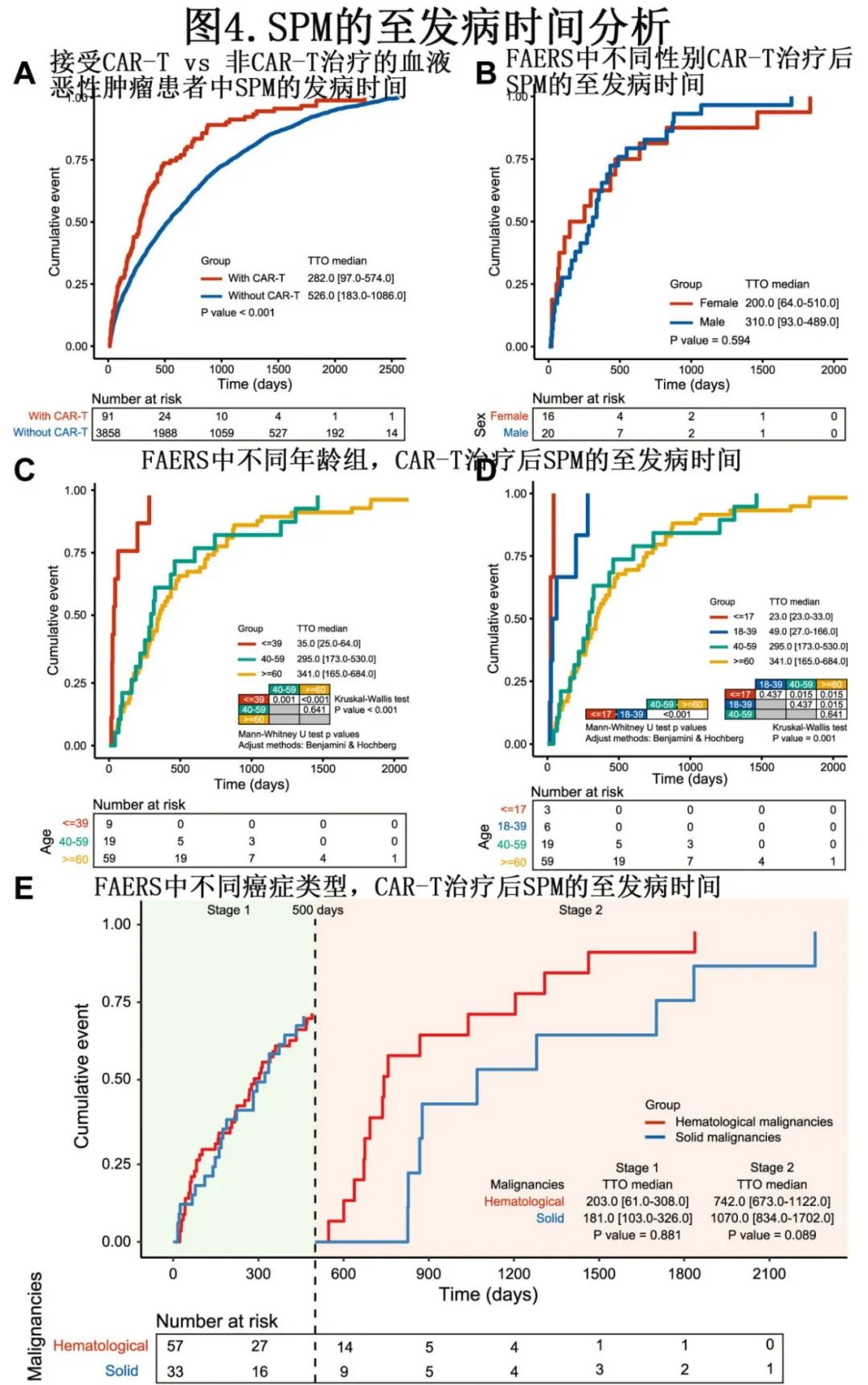
至SPM发病时间分析
在 SPM 的至发病时间(time to onset,TTO)分析中,与CAR-T非受者相比,CAR-T受者的中位 SPM 发病时间更早(中位TTO=282.0 vs 526.0天;P<0.001;图4A)。为进一步研究 CAR-T 人群中影响 TTO 的潜在因素,使用 FAERS 的数据进行了控制患者性别、年龄和癌症亚型的进一步分析。关于性别,未观察到女性和男性 CAR-T 受者之间 TTO 具有差异(图4B),而年龄是影响 CAR-T 受者中 TTO 的显著因素(图4C 和D)。与40-59岁(295.0天;P=0.001)或60岁以上(341.0天;P<0.001)患者相比,儿童、青少年和年轻成人患者(0-39岁;35.0天)具有更早的 SPM 表现。此外探索了癌症亚型对 SPM TTO 的影响,发现与 HM 相比,实体瘤表现出延迟的趋势,中位 TTO 更长(中位500天后,742 vs 1070.0天;P=0.089),但差异无统计学意义(图4E)。
总结
CAR-T 细胞治疗后的 SPM 包括血液恶性肿瘤和实体瘤,T 细胞淋巴瘤、髓系恶性肿瘤和实体瘤SPM的报告频率较高。在总体和亚组分析中,T细胞淋巴瘤和骨髓增生异常综合征均为阳性信号。血液学 SPM发病更早(CAR-T 治疗后年发病率增加),而实体瘤表现出延迟。CAR-T 受者 SPM发病明显早于非CAR-T受者。此外,年龄特异性特征显示,与 CAR-T 治疗后的老年人群相比,儿童、青少年和年轻成年人的 SPM 表现更早。
尽管该国际性药物警戒数据库研究仍无法推断 CAR-T 治疗和检测到的 SPM 之间存在确定的因果关系,但发现的阳性 SPM 信号至关重要,可能不仅仅归因于既往非 CAR-T 治疗,但需要在未来的 CAR-T 监测工作中进行验证。鉴于观察到 SPM 每年增加,该研究SPM 特征强调了对所有 CAR-T 受者进行长期安全性监测的必要性。此外,在不同年龄组中定制特异性的长期 SPM 筛查可能会增强早期检测和干预策略,最终改善 CAR-T 受者随访中的患者结局。
当然也要注意,CAR-T疗法引入的“生存偏倚”大大延长了高危患者的寿命,在确认CAR-T 与 SPM 率增加之间的因果关系之前必须考虑到这一点。因此,有必要通过全面的临床观察性研究和机制研究进行进一步验证。
参考文献
Shen J, Hu R,Lin A,et al.Characterization of second primary malignancies post CAR T-cell therapy: real-world insights from the two global pharmacovigilance databases of FAERS and VigiBase.EClinicalMedicine . 2024 Jun 20:73:102684. doi: 10.1016/j.eclinm.2024.102684.